题目内容
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:![]() △H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
△H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
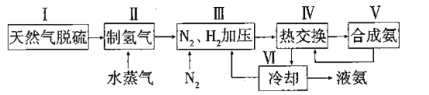
(1)步骤II中制氯气原理如下:
I.![]() △H=+206.4kJ·L-1
△H=+206.4kJ·L-1
II.![]() △H=-41.2kJ·L-1
△H=-41.2kJ·L-1
①对于反应I,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是____________________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应II,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为_______________。
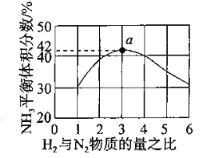
(2)图1表示500℃、60.0Mpa条件下,原料气投料比平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________。
(3)上述流程图中,使合成氨气放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:_______________。
【答案】a 90% 14.5% Ⅳ 对原料气加压,分离液氨,未反应的氮气和氢气循环使用
【解析】
天然气脱硫后得到纯净的甲烷,甲烷与水蒸气反应生成H2和CO,为了得到更多的H2,CO又与水蒸气反应,生成的H2再加入N2后经过加压,利用合成氨放出的热量进行预热处理,再在合成塔里反应,反应后经过热交换后分离出液氨,剩余的混合气体N2和H2循环使用。
⑴①a. 升高温度,速率加快,平衡向吸热反应即正向移动,氢气百分含量增大;b. 增大水蒸气浓度,反应速率加快,平衡正向移动,虽然氢气量增加,但平衡移动是微弱的,总的体积增加的多,氢气百分含量减少;c. 加入催化剂,速率加快,平衡不移动,氢气百分含量不变;d. 降低压强,速率减慢;②建立三段式并根据题意解答。
⑵假设氮气物质的量为1mol,氢气物质的量为3mol,建立三段式并根据题意列出关系式,最后计算N2的平衡体积分数。
⑴①a. 升高温度,速率加快,平衡向吸热反应即正向移动,氢气百分含量增大,故a符合题意;b. 增大水蒸气浓度,反应速率加快,平衡正向移动,虽然氢气量增加,但平衡移动是微弱的,总的体积增加的多,氢气百分含量减少,故b不符合题意;c. 加入催化剂,速率加快,平衡不移动,氢气百分含量不变,故c不符合题意;d. 降低压强,速率减慢,故d不符合题意;综上所述,答案为a。
②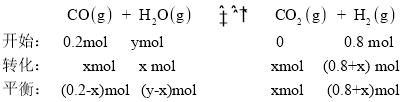
0.2x+x+0.8+x =1.18,则x =0.18,则CO转化率为![]() ;故答案为:90%。
;故答案为:90%。
⑵假设氮气物质的量为1mol,氢气物质的量为3mol,建立三段式 ,
,![]() ,解得x=0.591,N2的平衡体积分数为
,解得x=0.591,N2的平衡体积分数为![]() ;故答案为:14.5%。
;故答案为:14.5%。
⑶上述流程图中,使合成氨气放出的能量得到充分利用是将放出的热量用于原料气预热,主要步骤是IV。该反应是体积减小的反应,因此加压可提高合成氨原料总转化率,分离液氨,未反应的氮气和氢气循环使用提高原料利用率,因此本流程中提高合成氨原料总转化率的方法主要是对原料气加压,分离液氨,未反应的氮气和氢气循环使用;故答案为:IV;对原料气加压,分离液氨,未反应的氮气和氢气循环使用。