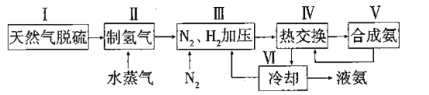
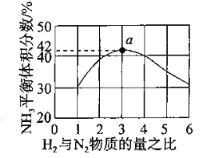
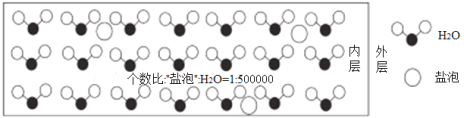
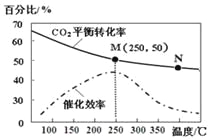
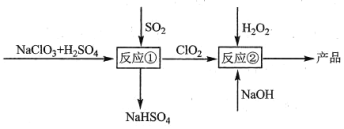
题目内容
【题目】镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,该材料中Ni为主要活泼元素,通常可以简写为LiAO2。充电时总反应为LiAO2+nC=Li1-xAO2+LixCn(0<x<1),工作原理如图所示,下列说法正确的是
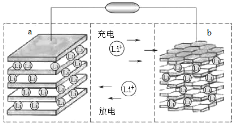
A.放电时Ni元素最先失去电子
B.放电时电子从a电极由导线移向b电极
C.充电时的阳极反应式为LiAO2 xe-= Li1-xAO2 + xLi+
D.充电时转移1mol电子,理论上阴极材料质量增加7g
【答案】CD
【解析】
镍钴锰的金属活泼性决定失电子的先后顺序,原电池中电子是从负极流向正极,根据锂离子移动方向得到a是正极,b是负极,充电时总反应为LiAO2+nC=Li1-xAO2+LixCn(0<x<1),在阳极上是失电子的氧化反应,即LiAO2 xe-= Li1-xAO2 + xLi+,充电时的两极反应和放电时的两极反应正好相反,据此回答。
A.镍钴锰的金属活泼性决定失电子的先后顺序,镍钴锰三元材料中Ni为主要活泼元素,电池中有锂,放电时锂元素最先失去电子,故A错误;
B.根据锂离子移动方向得到b是负极,a是正极,原电池中电子是从负极流向正极,即放电时电子从b电极由导线移向电极a,故B错误;
C.放电时总反应为LiAO2+nC=Li1xAO2+LixCn(0<x<1),则此时负极上反应式为LiAO2 xe-= Li1-xAO2 + xLi+,故C正确;
D.充电时转移1mol电子,理论上阴极材料质量增加1mol Li的质量,即7g,故D正确;
答案选CD。

练习册系列答案
相关题目