题目内容
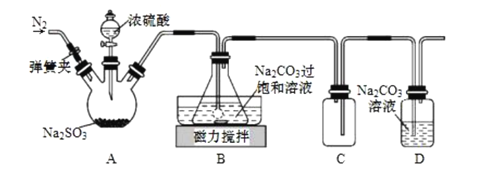
【题目】某同学按下图所示实验装置探究铜与浓硫酸的反应,记录实验现象见下表。
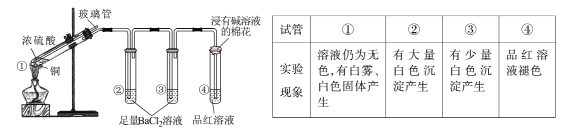
下列说法正确的是
A.②中白色沉淀是BaSO3
B.①中可能有部分硫酸挥发了
C.为确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
【答案】B
【解析】
实验探究铜与浓硫酸的反应,装置1为发生装置,溶液仍为无色,原因可能是混合体系中水太少,无法电离出铜离子,有白雾说明有气体液化的过程,同时产生白色固体,该固体可能是无水硫酸铜;试管2、3中有白色沉淀生成,该沉淀应为硫酸钡,说明反应过程有SO3生成或者硫酸挥发,3中沉淀较少,说明三氧化硫或挥发出的硫酸消耗完全;试管4中品红褪色说明反应中生成二氧化硫,浸有碱的棉花可以处理尾气,据此分析作答。
A. 二氧化硫不与氯化钡反应,白色沉淀不可能是BaSO3,故A错误;
B. 根据分析可知①中可能有部分硫酸挥发了,故B正确;
C. 冷却后的试管中仍有浓硫酸剩余,浓硫酸稀释放热,不能将水注入试管,会暴沸发生危险,故C错误;
D. 反应过程中SO3可能是氧气将二氧化硫氧化生成,若先往装置内通入足量N2,体系内没有氧气,则无SO3生成,试管2、3中将无沉淀产生,实验现象发生变化,故D错误;
故答案为B。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】30℃时,利用下图装置进行实验,结果记录如下表所示:

实验 | a电极 | b电极 | 电解质溶液 | 现象 |
I | Cu | Zn | 稀H2SO4 | 检流计指针向左偏转 |
II | Fe | Al | 稀H2SO4 | 检流计指针向左偏转 |
III | Fe | Al | 浓H2SO4 | 检流计指针先向左偏转,后逐渐归零,a电极表面逐渐变黑,b电极表面逐渐变白 |
IV | Fe | Al | 浓HNO3 | 检流计指针迅速向右偏转,a电极逐渐溶解,b电极表面逐渐变白 |
下列说法不正确的是( )
A. II中Al为负极,其电极反应是:Al - 3e- = Al3+
B. III中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行
C. IV中Fe为负极,发生了氧化反应
D. 上述实验表明:相同条件下,Fe在浓HNO3中更稳定,Al在浓H2SO4中更稳定