题目内容
【题目】聚硅酸铁是将铁离子引入到活性硅酸而制得的复合型混凝剂。用废铁皮(主要成分Fe和Fe3O4,少量碳)为原料制备的流程如下:
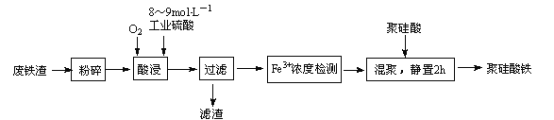
(1)废铁渣进行“粉碎”的目的是_________________。
(2)在实验室进行过滤操作时,所用到玻璃仪器有___________________________。
(3)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等条件,其中酸浸温度对铁浸取率的影响如下表所示:
温度(℃) | 40 | 60 | 80 | 100 | 120 |
铁浸取率(%) | 50 | 62 | 79 | 92 | 83 |
已知:在一定温度下,Fe3+在pH=2开始沉淀,pH=3.7沉淀完全。
①酸浸时应控制溶液的pH___________
②酸浸时通入O2的目的是_______________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是__________________________。
(4)滤渣的主要成分为____________________________(填化学式)。
(5)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为_________________________;
已知称取2.60 g聚硅酸铁产品,加入硫酸,再加入足量SnCl2,用0.2000 mol/L K2Cr2O7标准溶液滴定,消耗K2Cr2O7溶液的体积为20.00 mL,则聚硅酸铁产品中铁元素的百分含量为_____________________(结果保留两位有效数字)。
【答案】减小颗粒直径,增大浸取时的反应速率和提高铁浸取率 烧杯、漏斗、玻璃棒 <2 氧化Fe2+为Fe3+ 温度超过100℃时,Fe3+水解反应速率明显加快,导致Fe3+浓度降低 C Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O 52%
【解析】
主要成分为Fe和Fe3O4、少量碳的废铁皮粉碎后用工业硫酸溶解,同时通入氧气,其中C不溶于稀硫酸,过滤后所得滤渣为C,而滤液中主要含有Fe3+,经检测Fe3+后,再加入聚硅酸,静置后即可得聚硅酸铁;
(1)对废铁渣进行粉碎的目的:减小颗粒直径,增大浸取时的反应速率和提高铁浸取率,故答案为:减小颗粒直径,增大浸取时的反应速率和提高铁浸取率;
(2)在实验室进行过滤操作时,要用漏斗过滤,玻璃棒引流,烧杯接滤液,所以要用到的玻璃仪器有:烧杯、漏斗、玻璃棒,故答案为:烧杯、漏斗、玻璃棒;
(3)①因Fe3+在pH=2 开始沉淀,pH=3.7 沉淀完全,则酸浸时应调节溶解的pH<2,防止溶液pH≥2时将有部分Fe3+沉淀损失,故答案为:<2;pH≥2时将有部分Fe3+沉淀损失;
②酸浸时有亚铁离子生成,通入氧气能将亚铁离子氧化为铁离子,故答案为:氧化Fe2+为Fe3+
③铁离子在水溶液中存在水解,温度升高有利于水解反应的进行,温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低,故答案为:温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低;
(4)废铁皮(主要成分Fe和Fe3O4,少量碳),在通氧气的条件下,用硫酸酸浸,Fe和Fe3O4与硫酸反应,而碳不溶解,过滤后滤渣的主要成分为碳,故答案为:C;
(5)在酸性条件下,用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),则亚铁离子被氧化为铁离子,发生的离子方程式为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O;由方程式可知,n(Fe2+)=6n(Cr2O72-)=6×0.2000 mol/L×0.020L,则铁元素的百分含量为![]() ×100% ≈52%,故答案为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O;52%。
×100% ≈52%,故答案为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O;52%。

 口算题天天练系列答案
口算题天天练系列答案