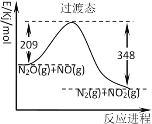
题目内容
【题目】现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀。请回答下列问题:

(1)写出下列物质的化学式:H________;D__________。
(2)写出下列转化的化学方程式或离子方程式:
①E+F→D+G的化学方程式:__________________________________;
②G+I→C+J的离子方程式:_________________________________。
(3)若要检验I物质的阳离子所加入的试剂是________________________。实验现象为:___________________________
【答案】Fe O2 2Na2O2+2H2O=4NaOH+O2↑ Fe3++3OH-=Fe(OH)3↓ KSCN或NaOH 溶液变红或产生红褐色沉淀
【解析】
根据题给信息:A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀,结合物质之间的转化关系,可推断出J为Fe(OH)3,E为Na2O2,F为H2O,G为NaOH,D为O2,由此可判断出A为Na,B为Cl2,C为NaCl,I为FeCl3,H为Fe。据此进行分析。
(1)由分析可知,H为Fe,D为O2,答案为:Fe;O2;
(2)①Na2O2和水反应生成NaOH和O2,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑;答案为:2Na2O2+2H2O=4NaOH+O2↑;
②FeCl3和NaOH发生复分解反应生成Fe(OH)3和NaCl,离子方程式为:Fe3++3OH-=Fe(OH)3↓;答案为:Fe3++3OH-=Fe(OH)3↓;
(3)利用Fe3+与KSCN反应生成血红色物质或Fe3+能跟碱反应生成红褐色沉淀等特征反应来检验Fe3+的存在,故答案为:KSCN或NaOH;溶液变红或产生红褐色沉淀。

 阅读快车系列答案
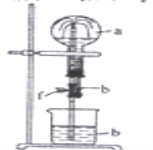
阅读快车系列答案【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是( )
a(干燥气体) |
| |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③B. ①②⑤C. ②④⑤D. ①②④
【题目】聚硅酸铁是将铁离子引入到活性硅酸而制得的复合型混凝剂。用废铁皮(主要成分Fe和Fe3O4,少量碳)为原料制备的流程如下:
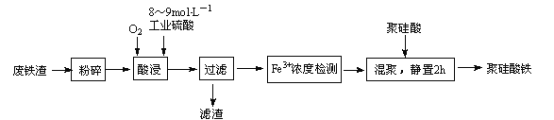
(1)废铁渣进行“粉碎”的目的是_________________。
(2)在实验室进行过滤操作时,所用到玻璃仪器有___________________________。
(3)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等条件,其中酸浸温度对铁浸取率的影响如下表所示:
温度(℃) | 40 | 60 | 80 | 100 | 120 |
铁浸取率(%) | 50 | 62 | 79 | 92 | 83 |
已知:在一定温度下,Fe3+在pH=2开始沉淀,pH=3.7沉淀完全。
①酸浸时应控制溶液的pH___________
②酸浸时通入O2的目的是_______________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是__________________________。
(4)滤渣的主要成分为____________________________(填化学式)。
(5)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为_________________________;
已知称取2.60 g聚硅酸铁产品,加入硫酸,再加入足量SnCl2,用0.2000 mol/L K2Cr2O7标准溶液滴定,消耗K2Cr2O7溶液的体积为20.00 mL,则聚硅酸铁产品中铁元素的百分含量为_____________________(结果保留两位有效数字)。