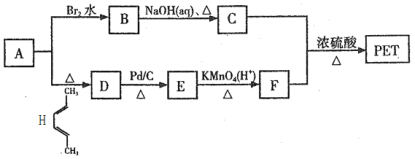
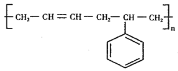
题目内容
【题目】某学习小组在实验室从海带中提取碘,设计实验流程如下:
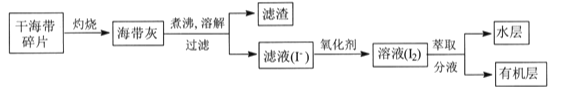
下列说法错误的是
A.过滤操作主要除去海带灰中难溶于水的固体,它们主要是无机物
B.氧化剂参加反应的离子方程式为2I-+H2O2+2H+=I2+2H2O
C.萃取过程所用有机溶剂可以是酒精或四氯化碳
D.因I2易升华,I2的有机溶液难以通过蒸馏法彻底分离
【答案】C
【解析】
实验室从海带中提取碘:将海带在坩埚中灼烧得到海带灰,将海带灰浸泡得到海带灰悬浊液,然后采用过滤的方法将残渣和溶液分离,得到含有碘化钾的溶液,向水溶液中加入氧化剂,将I-氧化成I2,向含有碘单质的溶液中加入萃取剂萃取分液得到碘单质的有机溶液,据此分析解答。
A.海带在坩埚中灼烧得到海带灰,有机物燃烧生成二氧化碳和水,过滤操作主要除去海带灰中难溶于水的固体,主要是无机物,故A正确;
B.氧化剂可以选用过氧化氢溶液,反应的离子方程式为2I-+H2O2+2H+=I2+2H2O,故B正确;
C.萃取过程所用有机溶剂可以是四氯化碳或苯,不能选用酒精,因为酒精易溶于水,故C错误;
D.因I2易升华,有机溶剂的沸点一般较低,因此I2的有机溶液通过蒸馏法难以彻底分离,故D正确;
故选C。

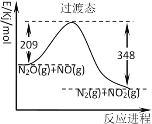
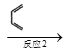
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4
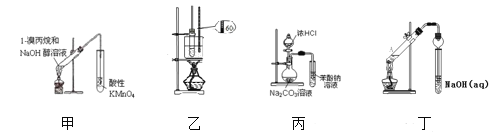
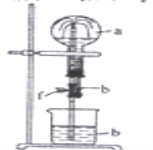
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是( )
a(干燥气体) |
| |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③B. ①②⑤C. ②④⑤D. ①②④
【题目】聚硅酸铁是将铁离子引入到活性硅酸而制得的复合型混凝剂。用废铁皮(主要成分Fe和Fe3O4,少量碳)为原料制备的流程如下:
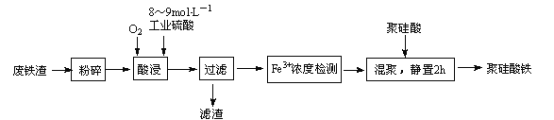
(1)废铁渣进行“粉碎”的目的是_________________。
(2)在实验室进行过滤操作时,所用到玻璃仪器有___________________________。
(3)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等条件,其中酸浸温度对铁浸取率的影响如下表所示:
温度(℃) | 40 | 60 | 80 | 100 | 120 |
铁浸取率(%) | 50 | 62 | 79 | 92 | 83 |
已知:在一定温度下,Fe3+在pH=2开始沉淀,pH=3.7沉淀完全。
①酸浸时应控制溶液的pH___________
②酸浸时通入O2的目的是_______________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是__________________________。
(4)滤渣的主要成分为____________________________(填化学式)。
(5)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为_________________________;
已知称取2.60 g聚硅酸铁产品,加入硫酸,再加入足量SnCl2,用0.2000 mol/L K2Cr2O7标准溶液滴定,消耗K2Cr2O7溶液的体积为20.00 mL,则聚硅酸铁产品中铁元素的百分含量为_____________________(结果保留两位有效数字)。