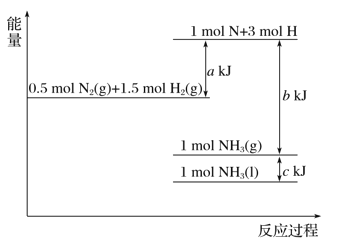
题目内容
【题目】根据下列实验:
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是
A. 氧化性Cu2+>Fe3+
B. ①中所得固体只含铜
C. ①中滤液含有Cu2+和Fe2+
D. ②中不会观察到溶液变红
【答案】D
【解析】
在实验①中会发生反应:Fe+Fe2(SO4)3=3FeSO4、Fe+CuSO4![]() FeSO4+Cu,由以上反应原理和氧化还原反应规律分析可得结论。
FeSO4+Cu,由以上反应原理和氧化还原反应规律分析可得结论。
A.在反应2Fe3++Cu=2Fe2++Cu2+中,氧化剂为Fe3+,氧化产物为Cu2+,即可知氧化性Fe3+> Cu2+,故A错误;
B.①中所得固体含有过量的铁和置换出的铜,故B错误;
C.由于加入的铁是过量的,则溶液中不可含有Cu2+,故C错误;
D.因在①的滤液中只有Fe2+,没有Fe3+,则滴加KSCN溶液时并不会出现溶液变红的现象,故D正确;
答案选D。

练习册系列答案
相关题目
【题目】在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
t /min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率υ(Z) = 2.0×103mol/(Lmin)
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆) < υ(正)
C. 该温度下此反应的平衡常数K=120
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大