题目内容
10. 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是C.
a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.增大体系压强
d.使用高效催化剂
(2)已知:CO(g)+$\frac{1}{2}$O2(g)═CO2(g0△H2=-283kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g0△H3=-242kJ•mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1
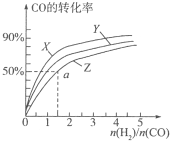
(3)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.请回答:
①在图中三条曲线,对应的温度由高到低的顺序是Z>Y>X
②利用a点对应的数据,计算出曲线Z在对应温度下CH3OH(g)?CO(g)+2H2(g)的平衡常数:K=0.25;
(4)恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应.
①达到平衡所需时间是I>Ⅱ(填“>”、“<”或“=”,下同).达到平衡后,两容器中CH3OH的体积分数关系是I<Ⅱ.
②平衡时,测得容器工中的压强减小了30%,则该容器中CO的转化率为45%.
分析 (1)根据平衡移动原理进行判断,温度升高,反应速率加快,使用催化剂,反应速率加快;
(2)根据盖斯定律和题中热化学方程式,根据反应
①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-242kJ•mol-1 ,
根据盖斯定律:①-②-③×2得写出甲醇完全燃烧生成二氧化碳的热化学方程式;
(3)①合成甲醇的反应是放热反应,温度升高,转化率降低,依据图象变化分析判断;
②a点时,CO转化率50%,反应消耗了2mol×50%=1molCO,消耗氢气2mol,图象中可知,起始量氢气物质的量n(H2)=1.5n(CO)=3mol,剩余1molCO,n(H2)=3mol-2mol=1mol,生成1mol甲醇,结合化学平衡三段式列式计算平衡浓度,根据平衡常数表达式和一氧化碳的转化率求算,K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(4)①恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中,反应前后气体体积减小,恒压容器中体积减小是相当于恒容容器达到平衡状态下,增大压强对平衡的影响,压强增大,反应速率增大,达到平衡需要的时间短,恒压容器中甲醇含量增大;
②平衡时,测得容器Ⅰ中的压强减小了30%,气体物质的量减小30%,结合化学平衡三段式列式计算;
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
3-2x=3-3×30%
x=0.45mol
转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)有利于增大该反应的反应速率且利于反应正向进行结合化学平衡移动原理分析.
A、随时将CH3OH与反应混合物分离,减小生成物的浓度,利于反应正向进行,但反应速率减小,故A错误;
B、反应是放热反应,温度降低,利于反应正向进行,但反应速率变小,故B错误;
C、反应前后气体体积减小,压强增大,利于反应正向进行,反应速率加快,故C正确;
D、使用催化剂,反应速率加快,不改变化学平衡,不能利于反应正向进行,故D错误;
故选C;
(2)根据反应①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-242kJ•mol-1 ,
根据盖斯定律:①-②-③×2得:
CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1,
故答案是:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1;
(3)①根据反应CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度最高,X对应的一氧化碳转化率最大,温度最低,Y介于二者之间,在图中三条曲线,对应的温度由高到低的顺序是Z>Y>X;
故答案是:Z>Y>X;
②a点时,CO转化率50%,反应消耗了2mol×50%=1molCO,消耗氢气2mol,图象中可知,起始量氢气物质的量n(H2)=1.5n(CO)=3mol,剩余1molCO,n(H2)=3mol-2mol=1mol,生成1mol甲醇,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 2 3 0
变化量(mol) 1 2 1
平衡量(mol) 1 1 1
a点各组分的浓度是:c(CH3OH)=$\frac{1mol}{2L}$=0.5mol/L,c(CO)=$\frac{1mol}{2L}$=0.5mol/L,c(H2)=$\frac{1mol}{2L}$=0.5mol/L,
带入表达式得:K=$\frac{0.5mol/L}{0.5mol/L×(0.5mol/L)^{2}}$=4L2•mol-2,
曲线Z在对应温度下CH3OH(g)?CO(g)+2H2(g)的平衡常数为上述平衡常数的倒数=0.25;
故答案是:0.25;
(4)①恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中,发生反应CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1 ;反应前后气体体积减小,恒压容器中体积减小是相当于恒容容器达到平衡状态下,增大压强对平衡的影响,压强增大,反应速率增大,达到平衡需要的时间短,ⅠⅡ达到平衡所需时间Ⅰ>Ⅱ,达到平衡后,恒压容器中平衡正向进行,所以两容器中CH3OH的体积分数Ⅰ<Ⅱ;
故答案为:>,<;
②平衡时,测得容器Ⅰ中的压强减小了30%,气体物质的量减小30%
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
测得容器Ⅰ中的压强减小了30%,气体物质的量减小30%
3-2x=3-3×30%
x=0.45mol
则该容器中CO的转化率=$\frac{0.45mol}{1mol}$×100%=45%;
故答案为:45%.
点评 本题考查了影响反应速率的因素及反应平衡常数的计算、热化学方程式的书写等知识,注意盖斯定律的应用,本题难度中等.

| A. | 发展核电、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效减少环境污染 | |
| B. | 物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化 | |
| C. | 氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力 | |
| D. | 农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 |
| A. | PH3 | B. | NH3 | C. | H2O | D. | CH4 |
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率ν(Z)=2.0×10-5 mol/(L•min) | |
| B. | 4min时,ν(逆)>ν(正) | |
| C. | 该温度下,此反应的平衡常数K=1.44 | |
| D. | 7min时,反应还未达到平衡状态 |
| A. | 0.1mol/LCH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3.H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L Na2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
| A. | 光化学烟雾是氮氧化物受紫外线照射后与空气中的一些碳氢化合物作用后生成的一种有毒烟雾 | |
| B. | 以粮食为原料酿酒过程的变化包括粮食→淀粉→葡萄糖→乙醇 | |
| C. | 航天飞机上使用的隔热陶瓷瓦,大多是以碳纤维做增强体的新型复合材料 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为
 ;
;(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在③~⑦元素中,原子半径最大的是Na,原子半径最小的是Cl;
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
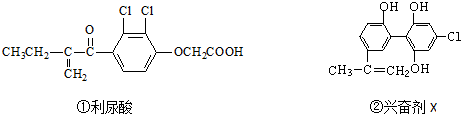
则关于它们的说法中正确的是( )
| A. | 利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰 | |
| B. | 1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2 | |
| C. | 两种兴奋剂最多都能和含3molNaOH的溶液反应 | |
| D. | 两种分子中的所有碳原子均不可能共平面 |