题目内容
19.如表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为
 ;
;(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在③~⑦元素中,原子半径最大的是Na,原子半径最小的是Cl;
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
分析 由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;
(2)稀有气体Kr的化学性质最不活泼,其原子核外有18个电子,各层电子数为2、8、8;
(3)氟元素没有最高价含氧酸,上述元素中最高价氧化物对应的水化物中酸性最强的是高氯酸;钾的金属性最强,故氢氧化钾的碱性最强;Al(OH)3为两性氢氧化物;
(4)同周期自左而右原子半径减小;
(5)同一主族从上到下非金属性减弱,单质的活泼性逐渐减弱,可以根据单质间的置换反应来证明.
解答 解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中,金属性最强的元素是K,最活泼的非金属元素是F,
故答案为:K;F;
(2)稀有气体Kr的化学性质最不活泼,其原子核外有18个电子,各层电子数为2、8、8,其原子结构示意图为: ,
,
故答案为:Ar; ;
;
(3)上述元素中除F(F没有正价)外Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,Al(OH)3为两性氢氧化物,
故答案为:HClO4;KOH;Al(OH)3;
(4)同周期自左而右原子半径减小,在③~⑦元素中,原子半径最大的是Na,原子半径最小的是Cl,
故答案为:Na;Cl;
(5)同一主族从上到下非金属性减弱,单质的活泼性逐渐减弱,所以氯气的活泼性强于溴单质,可以通过水溶液中的置换反应来证明,反应方程式为:2NaBr+Cl2=2NaCl+Br2,
故答案为:Cl2;2NaBr+Cl2=2NaCl+Br2.
点评 本题考查位置结构性质的应用,需要学生熟悉元素在周期表中的结构,注意掌握金属性、非金属性强弱比较实验事实.

| A. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 误将洁厕灵与84消毒液混合:H++Cl-+HClO=Cl2↑+H2O | |
| C. | 酸性高锰酸钾和过氧化氢制取少量氧气:2MnO4-+12H++4H2O2═4Mn2++7O2↑+10H2O | |
| D. | 用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁:Mg(OH)2+2NH4+=Mg2++2NH3•H2O |
①取代反应 ②加成反应 ③消去反应 ④使溴的四氯化碳溶液褪色
⑤聚合反应 ⑥使酸性高锰酸钾溶液褪色.
| A. | 全部 | B. | 除⑤外 | C. | 除①外 | D. | 除①、⑤外 |
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 充电过程中,电池正极材料的质量增加 | |
| D. | 放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |
| A. | 标准状况下,40 g SO3所含的氧原子的数目为1.5 NA | |
| B. | 5.6 g铁与足量氯气或硫蒸气反应转移的电子数均为0.3 NA | |
| C. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA | |
| D. | 常温下5.6 g铁投入到足量浓硝酸中反应,转移电子数为0.3 NA |
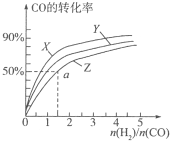 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1


 ;DB2有多种重要的用途,请你写出其中的一种:制玻璃、制光导纤维、制粗硅(其中一种).
;DB2有多种重要的用途,请你写出其中的一种:制玻璃、制光导纤维、制粗硅(其中一种). .
.