题目内容
15.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1mol/LCH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3.H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L Na2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
分析 A、0.1mol/LCH3COONa溶液与0.1mol/L HCl溶液等体积混合发生反应生成醋酸和氯化钠,钠离子浓度和氯离子浓度相同;
B、0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合后溶液pH>7,说明一水合氨电离大于铵根离子水解;铵根离子浓度大于一水合氨;
C、0.1mol/L Na2CO3与0.1mol/LNaHCO3溶液等体积混合溶液中存在物料守恒,2n(Na)=3n(C);
D、0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合生成醋酸钠,溶液中存在质子守恒,水电离出的氢离子浓度和氢氧根离子浓度相同.
解答 解:A、0.1mol/LCH3COONa溶液与0.1mol/L HCl溶液等体积混合发生反应生成醋酸和氯化钠,钠离子浓度和氯离子浓度相同,溶液中离子浓度大小为;c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-),故A错误;
B、0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合后溶液pH>7,说明一水合氨电离大于铵根离子水解;铵根离子浓度大于一水合氨,c(NH4+)>c(Cl-)>c(NH3.H2O)>c(OH-),故B错误;
C、0.1mol/L Na2CO3与0.1mol/LNaHCO3溶液等体积混合溶液中存在物料守恒,2n(Na)=3n(C),物料守恒为:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3),故C正确;
D、0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合生成醋酸钠,溶液中存在质子守恒,水电离出的氢离子浓度和氢氧根离子浓度相同,所得溶液中:c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选C.
点评 本题考查了电解质溶液中离子浓度大小比较、电荷守恒、物料守恒、质子守恒的分析判断,掌握基础是关键,题目难度中等.

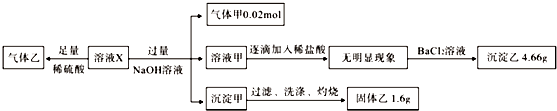
则下列说法正确的是( )
| A. | 若含有Fe3+,则一定含有Cl- | |
| B. | SO42-、NH4+一定存在,NO3-、Cl-可能不存在 | |
| C. | CO32-、Al3+、K+一定不存在 | |
| D. | 气体甲、沉淀甲一定为纯净物 |
| A. | 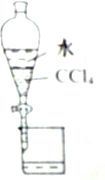 分离CCl4和水 | |
| B. |  洗涤沉淀时,向漏斗中加适量水,搅拌并滤干 | |
| C. | 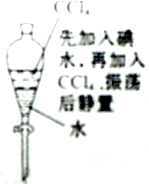 液体分层,下层呈无色 | |
| D. | 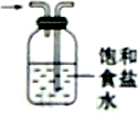 除去氯气中的氯化氢 |
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
| A. | 平衡后升高温度,平衡常数>400 | |
| B. | 平衡时,c(CH3OCH3)=1.6 mol•L-1 | |
| C. | 平衡时,反应混合物的总能量减少40 kJ | |
| D. | 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大 |
①取代反应 ②加成反应 ③消去反应 ④使溴的四氯化碳溶液褪色
⑤聚合反应 ⑥使酸性高锰酸钾溶液褪色.
| A. | 全部 | B. | 除⑤外 | C. | 除①外 | D. | 除①、⑤外 |
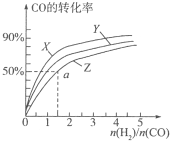 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1


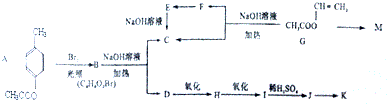
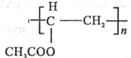 ,B中具有的官能团的名称酯基、溴原子.
,B中具有的官能团的名称酯基、溴原子. .
.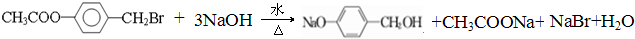 .
.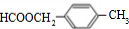 .
.