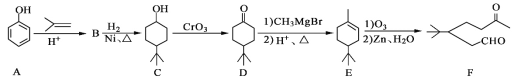
题目内容
【题目】为了测定含氰废水中CN- 的含量,某化学小组利用如图所示装置进行实验。关闭活塞a,将100ml含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应,打开活塞b,滴入稀硫酸,然后关闭活塞b。
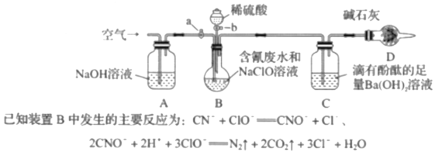
(1)B中盛装稀硫酸的仪器的名称是_____________。
(2)装置D的作用是_________________,装置C中的实验现象为______________。
(3)待装置B中反应结束后,打开活塞a,经过A装置缓慢通入一段时间的空气
①若测得装置C中生成59.1mg沉淀,则废水中CN-的含量为_________mg·L-1 。
②若撤去装置A,直接向装置B中缓慢通入一段时间的空气,则测得含氰废水中CN-的含量__________(选填“偏大”、“偏小”、“不变”)。
(4)向B中滴入稀硫酸后会发生某个副反应而生成一种有毒的黄绿色气体单质,该副反应的离子方程式为_________________。
(5)除去废水中CN-的一种方法是在碱性条件下,用H2O2将CN-氧化生成N2,反应的离子方程式为_____________________________。
【答案】分液漏斗 防止空气中的CO2进入装置C中 有白色沉淀生成,溶液的红色逐渐变浅(或褪去) 78 偏大 Cl-+ClO-+2H+=Cl2↑+H2O 5H2O2+2CN-=N2↑+2HCO3-+4H2O (或5H2O2+2CN-+2OH-=N2↑+2CO32-+6H2O)
【解析】
实验的原理是利用CN+ClO═CNO+Cl;2CNO+2H++3ClO═N2↑+2CO2↑+3Cl+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,装置A是除去通入空气中所含二氧化碳,装置B中的反应是CN+ClO═CNO+Cl;2CNO+2H++3ClO═N2↑+2CO2↑+3Cl+H2O,通过装置C吸收生成的二氧化碳,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置C实验数据的测定产生干扰,装置D的作用是排除空气中二氧化碳对实验的干扰。
(1)装置中B为分液漏斗;
(2)实验的原理是利用CN+ClO═CNO+Cl;2CNO+2H++3ClO═N2↑+2CO2↑+3Cl+H2O,通过测定C装置的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰;滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去;
(3)①CN+ClO=CNO+Cl、2CNO+2H++3ClO=N2↑+2CO2↑+3Cl+H2O,CO2+Ba(OH)2=BaSO4↓+H2O,结合化学方程式的反应关系计算;②若撤去装置A,直接向装置B中缓慢通入一段时间的空气,空气中二氧化碳也会和氢氧化钡溶液反应;
(4)向B中滴入稀硫酸后会发生某个副反应而生成一种有毒的气体单质为氯气,是氯离子和次氯酸根离子在酸溶液中发生氧化还原反应生成;
(5)除去废水中CN的一种方法是在碱性条件下,用H2O2将CN氧化生成N2,结合电子守恒、原子守恒和电荷守恒书写离子方程式。
(1)B中盛装稀硫酸的仪器的名称是分液漏斗,故答案为:分液漏斗;
(2)实验的原理是利用CN+ClO═CNO+Cl;2CNO+2H++3ClO═N2↑+2CO2↑+3Cl+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置C实验数据的测定产生干扰,装置D的作用是排除空气中二氧化碳对实验的干扰,滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去,故答案为:防止空气中的CO2和水蒸气进入C装置;有白色沉淀生成,溶液的红色逐渐变浅(或褪去);
(3)①依据反应CN+ClO═CNO+Cl;2CNO+2H++3ClO═N2↑+2CO2↑+3Cl+H2O,CO2+Ba(OH)2=BaCO3↓+H2O得到,装置C中生成59.1mg沉淀为BaCO3↓物质的量=![]() =3×104mol
=3×104mol
CNCNOCO2BaCO3↓
11
3×104mol3×104mol
c(CN)=![]() =0.078g/L=78g/L,故答案为:78;
=0.078g/L=78g/L,故答案为:78;
②若撤去装置A,直接向装置B中缓慢通入一段时间的空气,空气中二氧化碳也会和氢氧化钡溶液反应,生成碳酸钡出的质量会增大,测定含氰废水中CN的含量偏大,故答案为:偏大;
(4)向B中滴入稀硫酸后会发生某个副反应而生成一种有毒的气体单质为氯气,是氯离子和次氯酸根离子在酸溶液中发生氧化还原反应生成,反应的离子方程式为:Cl+ClO+2H+=Cl2↑+H2O,故答案为:Cl+ClO+2H+=Cl2↑+H2O;
(5)除去废水中CN的一种方法是在碱性条件下,用H2O2将CN氧化生成N2,结合电子守恒、原子守恒和电荷守恒书写离子方程式为:5H2O2+2CN-=N2↑+2HCO3-+4H2O (或5H2O2+2CN-+2OH-=N2↑+2CO32-+6H2O),
故答案为:5H2O2+2CN-=N2↑+2HCO3-+4H2O(或5H2O2+2CN-+2OH-=N2↑+2CO32-+6H2O)。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】(1)葡萄酒中SO2最大使用量为0.25 g·L-1,取300.00 mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。
①写出上述氧化还原反应的化学方程式:___________________
②若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积________(填序号)。
A.=10 mL B.=40 mL C. <10 mL D. >40 mL。
③若滴定终点时PH=8.8,可选择_______为指示剂
④滴定终点读数时俯视刻度线,则测量结果比实际值________(填“偏高”、“偏低”或“无影响”)。
(2)某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作为:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点并记下刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①正确操作步骤的顺序是(用序号字母填写)__________________________
②根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)