题目内容
【题目】现有25℃时,0.1 mol/L的氨水。请回答下列问题:
(1)若向0.1 mol·L-1氨水中加入少量硫酸铵固体,此时溶液中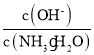 ____(填“增大”“减小”或“不变”)。
____(填“增大”“减小”或“不变”)。
(2)若向0.1mol·L-1氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol·L-1,则
c(SO42-)=_____________。
(3)若向0.1 mol·L-1氨水中加入pH=1的硫酸,且氨水与硫酸的体积比1:1,则所得溶液中各离子物质的量浓度由大到小的顺序是______________。
(4)将足量的AgCl固体分别放入: ①5mL水,②10mL 0.2mol·L-1MgCl2溶液,③20mL 0.5 mol·L-1 NaCI溶液,④40mL 0.1mol·L-1盐酸中溶解至溶液饱和,各溶液中Ag+的物质的量浓度分别为a、b、c、d,它们由大到小的排列顺序是______________。
【答案】减小 ![]() mol/L。 c(NH4+)>c(SO42-)>c(H+)>c(OH-) a>d>b>c
mol/L。 c(NH4+)>c(SO42-)>c(H+)>c(OH-) a>d>b>c
【解析】
⑴若向0.1 mol·L-1氨水中加入少量硫酸铵固体,增加了铵根离子浓度,电离平衡逆向移动,氢氧根离子浓度减小,一水合氨浓度增加,因此溶液中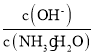 减小。
减小。
⑵若向0.1mol·L-1氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol·L-1,根据电荷守恒和溶液pH= 7,得到2c(SO42-)= c(NH4+)即可得。
⑶若向0.1 mol·L-1氨水,加pH=1的硫酸,c(H+)=0.1 molL-1,c(H2SO4)=0.05 molL-1,氨水与硫酸的体积比1:1,则两者恰好完全反应完生成硫酸铵,铵根离子要水解,溶液显酸性,虽然铵根离子水解,但铵根离子浓度大于硫酸根浓度,因此溶液中各离子物质的量浓度由大到小的顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-)。
⑷将足量的AgCl固体分别放入:氯离子浓度浓度越大,抑制AgCl的溶解,其银离子浓度越小,c(Cl-)大小顺序为:③②④①,因此各溶液中Ag+的物质的量浓度由大到小的排列顺序。
⑴若向0.1 mol·L-1氨水中加入少量硫酸铵固体,增加了铵根离子浓度,电离平衡逆向移动,氢氧根离子浓度减小,一水合氨浓度增加,因此溶液中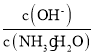 减小,故答案为:减小。
减小,故答案为:减小。
⑵若向0.1mol·L-1氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol·L-1,根据电荷守恒和溶液pH= 7,得到2c(SO42-)= c(NH4+)即c(SO42-) = ![]() molL-1,故答案为:
molL-1,故答案为:![]() molL-1。
molL-1。
⑶若向0.1 mol·L-1氨水,加pH=1的硫酸,c(H+)=0.1 molL-1,c(H2SO4)=0.05 molL-1,氨水与硫酸的体积比1:1,则两者恰好完全反应完生成硫酸铵,铵根离子要水解,溶液显酸性,虽然铵根离子水解,但铵根离子浓度大于硫酸根浓度,因此溶液中各离子物质的量浓度由大到小的顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-)。
⑷将足量的AgCl固体分别放入:氯离子浓度浓度越大,抑制AgCl的溶解,其银离子浓度越小,c(Cl-)大小顺序为:③②④①,因此各溶液中Ag+的物质的量浓度由大到小的排列顺序是a>d>b>c,故答案为:a>d>b>c。

【题目】800℃时,可逆反应 CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数 K=1,800℃时,测得某一时刻密闭容器中各组分的浓度如表,下列说法正确的是( )
物质 | CO | H2O | CO2 | H2 |
浓度/molL-1 | 0.002 | 0.003 | 0.0025 | 0.0025 |
A.此时平衡逆向移动
B.达到平衡后,气体压强降低
C.若将容器的容积压缩为原来的一半,平衡可能会向正向移动
D.正反应速率逐渐减小,不变时,达到化学平衡状态