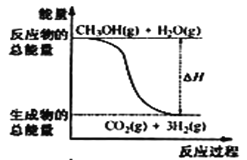
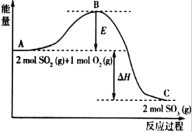
题目内容
【题目】NaNO2是一种白色易溶于水的固体,溶液呈碱性,其外观与氯化钠相似,有咸味,俗称工业盐;是一 种重要的化学试剂、漂白剂和食品添加剂。已知亚硝酸盐能被溴水氧化,在酸性条件下能氧化亚铁离子; 亚硝酸银是可溶于稀硝酸的白色沉淀。
请完成以下填空:
(1)N原子最外层电子的轨道排布式为_______;用一个事实说明氮和氧非金属强弱_______。
(2)酸性条件下,NaNO2溶液只能将I-氧化为I2,同时生成NO。写出此反应①的离子方程式并标出电子转移的方向和数目______。
(3)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,工业上氧化卤水中的I-提取单质I2选择了价格并不便宜的亚硝酸钠,可能的原因是_______。
(4)在盐酸溶液中加入亚硝酸钠溶液至中性,则c(Cl-)_____c(HNO2)(填“<”、“>”或“=”)。
(5)设计一种鉴别亚硝酸钠和氯化钠的实验方案。_______
【答案】![]() 氢化物稳定性:H2O>NH3,氧强于氮
氢化物稳定性:H2O>NH3,氧强于氮 ![]() 氯气、浓硝酸、酸性高锰酸钾氧化性太强,还能继续氧化I2 = 取样溶于水,分别测定它们的pH值, 一种pH值大于7,一种pH值等于7, pH值大于7的为亚硝酸钠,pH值等于7的为氯化钠
氯气、浓硝酸、酸性高锰酸钾氧化性太强,还能继续氧化I2 = 取样溶于水,分别测定它们的pH值, 一种pH值大于7,一种pH值等于7, pH值大于7的为亚硝酸钠,pH值等于7的为氯化钠
【解析】
(1)氮原子最外层有5个电子,先排2s轨道,另外3个排在3个2p轨道里;元素的非金属性越强,形成的气态氢化物就越稳定;
(2)亚硝酸钠具有氧化性,碘离子具有还原性,酸性条件下,二者发生氧化还原反应生成一氧化氮、碘和水;
(3)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(4)根据亚硝酸钠溶液中水解平衡和酸碱中和解答;
(5)根据亚硝酸钠和氯化钠的不同性质来进行区分。
(1)氮原子最外层有5个电子,先排2s轨道,另外3个排在3个2p轨道里,氮原子最外层电子排布轨道表示式为:![]() ;元素的非金属性越强,形成的气态氢化物就越稳定,氢化物稳定性:H2O>NH3,非金属性氧强于氮;
;元素的非金属性越强,形成的气态氢化物就越稳定,氢化物稳定性:H2O>NH3,非金属性氧强于氮;
(2)亚硝酸钠具有氧化性,碘离子具有还原性,酸性条件下,二者发生氧化还原反应生成一氧化氮、碘和水,离子反应方程式为:2I-+2NO2-+4H+=I2+2NO+2H2O,电子转移的方向和数目为:![]() ;
;
(3)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质,故工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠;故答案为:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(4)亚硝酸钠溶液中发生水解反应NO2-+H2O![]() HNO2+OH-而呈碱性,在盐酸溶液中加入亚硝酸钠溶液至中性说明亚硝酸钠水解产生的氢氧根等于盐酸溶液中的氢离子,即c(OH-)= c(H+),又因为c (OH-)= c(HNO2),盐酸溶液中c (H+)= c(Cl-),所以c(Cl-)=c(HNO2);
HNO2+OH-而呈碱性,在盐酸溶液中加入亚硝酸钠溶液至中性说明亚硝酸钠水解产生的氢氧根等于盐酸溶液中的氢离子,即c(OH-)= c(H+),又因为c (OH-)= c(HNO2),盐酸溶液中c (H+)= c(Cl-),所以c(Cl-)=c(HNO2);
(5)根据亚硝酸钠和氯化钠的不同性质来进行区分,根据所给的信息及我们所学的氯化钠的性质可以知道:亚硝酸钠是强碱弱酸盐,其溶液呈碱性,而氯化钠溶液时中性,所以可以取样溶于水,分别测定它们的pH值, 一种pH值大于7,一种pH值等于7, pH值大于7的为亚硝酸钠,pH值等于7的为氯化钠。

 走进文言文系列答案
走进文言文系列答案【题目】为检验一批因露置而部分变质的Ba(OH)2药品的成分,某化学探究性学习小组设计了方案对其进行将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。

(1) 写出硫酸工业尾气与过量的Ba(OH)2反应的离子方程式:________________________
(2)提出以下三种合理假设:(已知在空气中Ba(OH)2很难生成酸式盐)
假设一:药品成分为Ba(OH)2和BaSO4、BaSO3;
假设二:药品成分为Ba(OH)2和________________;
假设三:药品成分为Ba(OH)2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
实验操作 | 预期实验现象和结论 |
| 若____________________,假设一成立; |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)
【题目】CO2是廉价的碳资源,其综合利用具有重要意义。
(1)CO2与CH4经催化重整反应CH4(g)+CO2(g)2CO(g)+2H2(g)△H=+120kJ·mol-1可以制得合成气。
已知上述反应中相关物质所含化学键键能数据如下:
化学键 | C-H | C=O | H-H | C≡O(CO) |
键能/kJ·mol-1 | a | b | c | x |
①x=___。
②分别在恒温密闭容器A(恒容)、B(恒压,体积可变)中,加入CH4和CO2各1mol的混合气体,起始体积均为VL。相同温度下两容器中反应达平衡后吸收热量较多的是___ (填“A”或“B”)。保持A容器的体积和B容器压强不变,写出一种能使A、B两容器中各物质的体积分数相同的方法:___。
③某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行反应,达到平衡时CO2的体积分数为![]() ,该温度下反应的平衡常数为___。
,该温度下反应的平衡常数为___。
(2)CO2可以被NaOH捕获。所得溶液中含碳微粒的分布百分数随pH的变化如图所示。H2CO3的二级电离平衡常数Ka2=___。pH=5.4时,φ(A):φ(B)=___。