题目内容
14.在一定温度下的定容容器中,反应:A(s)+2B(g)?C(g)+D(g).下列不能表明反应达到平衡状态的是( )| A. | 气体的压强不变 | B. | 气体平均相对分子质量不变 | ||
| C. | 气体的密度不变 | D. | B物质的量浓度不变 |
分析 反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断.解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态
解答 解:A、可逆反应:A(s)+2B(g)?C(g)+D(g),反应前后,气体的物质的量不发生变化,体积恒定,反应自开始到平衡,压强都是一定值,故A错误;
B、该反应是一个反应前后气体体积不变的化学反应,气体平均相对分子质量不变,说明气体的质量不变,所以达平衡状态,故B正确;
C、气体的密度不变,说明气体的质量不变,正逆反应速率相等,故C正确;
D、B物质的量浓度不变,说明消耗B和生成B的速率相等,故D正确.
故选A.
点评 本题考查化学平衡状态的判断,难度不大,化学平衡状态的判断是高考的热点,平衡状态的本质是正逆反应速率相等.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
20. A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.
A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是二周期、ⅣA族;用电子式表示A和E形成的化合物的形成过程.
(2)A、D、E、F离子半径由大到小的顺序为S2->O2->Mg2+>Al3+.
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O (g)$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2.该反应为吸热反应.(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为Al2O3+6H+=2Al3++3H2O.
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O;外电路中电子从Al电极流向Mg电极.
 A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.
A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
(1)B在元素周期表中的位置是二周期、ⅣA族;用电子式表示A和E形成的化合物的形成过程.
(2)A、D、E、F离子半径由大到小的顺序为S2->O2->Mg2+>Al3+.
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O (g)$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2.该反应为吸热反应.(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为Al2O3+6H+=2Al3++3H2O.
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O;外电路中电子从Al电极流向Mg电极.
9. 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )| A. | 分子式为C20H20 | B. | 一氯代物的同分异构体只有四种 | ||
| C. | 分子中含有二个亚甲基(-CH2-) | D. | 分子中含有8个五元碳环 |
19.下列说法中不正确的是( )
| A. | 离子化合物中不一定含有金属元素 | |
| B. | 由不同原子所形成的纯净物不一定是化合物 | |
| C. | 分子中一定含有化学键 | |
| D. | 含有金属元素的离子不一定是阳离子 |
6.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | Cu2+、Mg2+、SO42- | B. | H+、Mg2+、CO32- | C. | Ag+、NO3-、Cl- | D. | Fe2+、H+、NO3- |
4.0.1mol/L的碳酸氢钠溶液存在下列离子,其中离子浓度最小的是( )
| A. | Na+ | B. | H+ | C. | HCO3- | D. | OH- |

 D
D
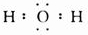
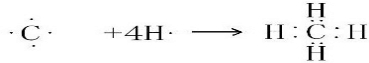 .
.