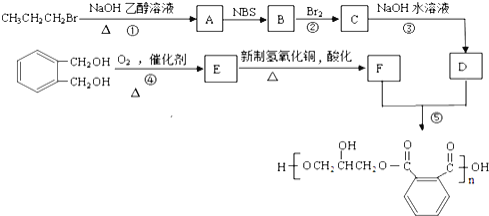
题目内容
【题目】(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是________________。
(2)A元素原子L层上有6个电子,B元素比A元素原子核外电子层数多1,B元素原子最外电子层只有1个电子。
①B元素的原子结构示意图________________。
②A、B两元素形成的化合物化学式是______________,该化合物与CO2反应的化学方程式是________________________。
(3)已知某粒子的结构示意图为 ,试回答:
,试回答:
①当x-y=10时,该微粒为__________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,常见的微粒可能为(填元素符称)____________、____________、____________、K+、____________。
③写出y=3与y=7的元素最高价氧化物对应水化物之间发生反应的离子方程式____________________________________。
【答案】
 Na2O、Na2O2 Na2O+CO2=Na2CO3、2Na2O2+2CO2=2Na2CO3+O2 原子 Ar Cl- S2- Ca2+ Al(OH)3+3H+=Al3++3H2O
Na2O、Na2O2 Na2O+CO2=Na2CO3、2Na2O2+2CO2=2Na2CO3+O2 原子 Ar Cl- S2- Ca2+ Al(OH)3+3H+=Al3++3H2O
【解析】
(1)根据原子核外电子的排布规律来推断;
(2)根据L层上的电子数确定A是氧元素,B是Na元素,确定它们形成的化合物,写出化学方程式;
(3)①核电荷数等于核外电子数的微粒为原子;
②18电子的单核微粒包括原子、阴离子和阳离子几种情况;
③氢氧化铝具有两性,可以和强酸反应。
(1)设:核电荷数=质子数=a,元素原子的电子层数为x,最外层电子数为y,依题意:a=5x,a=3y,则5x=3y,x=![]() 。因原子的最外层电子数不超过8,即y为1~8的正整数,故仅当y=5,x=3时合理,该元素的核电荷数为15,原子结构示意图为 :
。因原子的最外层电子数不超过8,即y为1~8的正整数,故仅当y=5,x=3时合理,该元素的核电荷数为15,原子结构示意图为 : ;
;
(2)①A元素原子有2个电子层,且最外层电子数为6,由此可知A元素原子核外有8个电子,即为O;B元素原子核外有3个电子层,且最外层电子数为1,由此可知,B元素原子核外有11个电子,即为Na,原子结构示意图为: ;
;
②钠元素和氧元素可形成Na2O、Na2O2两种化合物,与CO2反应的化学方程式分别为:Na2O+CO2=Na2CO3、2Na2O2+2CO2=2Na2CO3+O2;
(3)①当x-y=10时,x=10+y,说明核电荷数等于核外电子数,所以该粒子应为原子;
②当y=8时,应为有18个电子的粒子,所以可能为氩原子、氯离子、硫离子、钾离子、钙离子,符号为:Ar、Cl-、S2-、Ca2+;
③y=3时为铝原子,y=7时为氯原子,其最高价氧化物对应的水化物分别为氢氧化铝和高氯酸,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】已知如下三个实验均能发生化学反应:
① | ② | ③ |
将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
下列判断正确的是
A.实验①中铁作还原剂B.实验②中![]() 既显氧化性又显还原性
既显氧化性又显还原性
C.实验③中发生的是置换反应D.上述实验证明氧化性:![]()