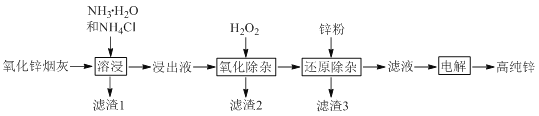
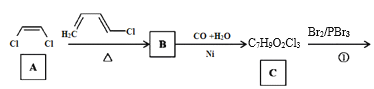
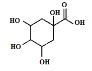
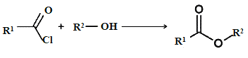题目内容
【题目】改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=![]() ]。下列叙述错误的是( )
]。下列叙述错误的是( )
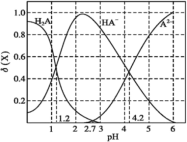
A.pH=1.2时,c(H2A)=c(HA-)
B.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
C.pH=4.2时,c(HA-)=c(A2-)=c(H+)
D.lg[K2(H2A)]=-4.2
【答案】C
【解析】
由图象可知,pH=1.2时,c(H2A)=c(HA),pH=2.7时,c(H2A)=c(A2),pH=4.2时,c(HA)=c(A2),随着pH的增大,c(H2A)逐渐减小,c(HA)先增大后减小,c(A2)逐渐增大,结合电离平衡常数以及题给数据计算,可根据纵坐标比较浓度大小,以此解答该题。
A.由图象可知pH=1.2时,H2A与HA的曲线相交,则c(H2A)=c(HA),故A正确;
B.由图象可知pH=2.7时,c(H2A)=c(A2),由纵坐标数据可知c(HA)>c(H2A)=c(A2),故B正确;
C.pH=4.2时,c(HA)=c(A2),但此时c(H2A)≈0,如体积不变,则c(HA)=c(A2)=0.05molL1,c(H+)=104.2mol/L,如体积变化,则不能确定c(HA)、c(A2)与c(H+)浓度大小关系,故C错误;
D.pH=4.2时,c(H+)=104.2mol/L,c(HA)=c(A2),K2(H2A)=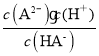 =104.2,则lg[K2(H2A)]=4.2,故D正确;
=104.2,则lg[K2(H2A)]=4.2,故D正确;
故答案选C。

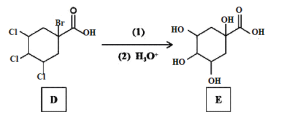
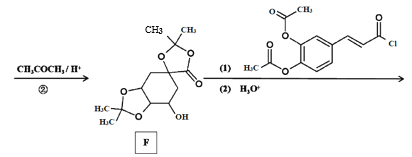
【题目】Ⅰ.呋喃甲酸是一种抗生素,在食品工业中作防腐剂,也作涂料添加剂医药、香料等中间体,可用呋喃甲醛制备,其实验原理和制备步骤如下:
2![]() +NaOH→
+NaOH→![]() +
+![]() H<0
H<0
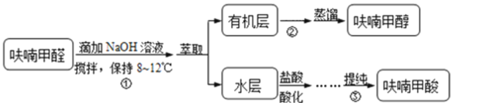
步骤③提纯过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥。
(1)步骤①的关键是控制温度,其措施有:磁力搅拌、__________和缓慢滴加![]() 溶液。
溶液。
(2)步骤②中,加入无水![]() 的作用_______。
的作用_______。
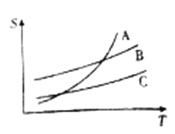
(3)呋喃甲酸在A、B、C三种溶剂中溶解度(S)随温度(T)变化的曲线如图。步骤③提纯时合适的溶解试剂是________。
Ⅱ.利用呋喃甲酸制取的呋喃甲酸正丁酯是一种优良的有机溶剂。某化学兴趣小组在实验室用呋喃甲酸和正丁醇制备呋喃甲酸正丁酯,有关物质的相关数据及实验装置如图所示:
化合物 | 相对分子质量 | 密度( | 沸点(℃) | 溶解度(g/100g水) |
呋喃甲酸 | 112 | 1.322 | 230-232 | 4.33 |
正丁醇 | 74 | 0.81 | 117.3 | 9 |
呋喃甲酸正丁酯 | 168 | 1.053 | 136.1 | 0.7 |
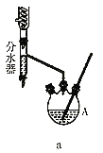

分水器的操作方法:先将分水器装满水(水位与支管口相平),再打开活塞,准确放出一定体积的水。在制备过程中,随着加热回流,蒸发后冷凝下来的有机液体和水在分水器中滞留分层,水并到下层(反应前加入的)水中;有机层从上面溢出,流回反应容器。当水层增至支管口时,停止反应。
呋喃甲酸正丁酯合成和提纯步骤为:
第一步:取足量的正丁醇和![]() 呋喃甲酸混合加热发生酯化反应,反应装置如图a所示(加热仪器已省略);
呋喃甲酸混合加热发生酯化反应,反应装置如图a所示(加热仪器已省略);
第二步:依次用水、饱和![]() 溶液、水对烧瓶中的产品洗涤并干燥;
溶液、水对烧瓶中的产品洗涤并干燥;
第三步:用装置b蒸馏提纯。
回答有关问题:
(4)装置A的名称_________。
(5)实验中使用分水器的优点有________。
(6)第二步用饱和![]() 溶液洗涤的目的是______。
溶液洗涤的目的是______。
(7)若实验中得到呋喃甲酸正丁酯![]() ,则呋喃甲酸正丁酯的产率为________。实验中呋喃甲酸正丁酯的实际产率总是小于此计算值,不可能原因是_______(填字母代号)。
,则呋喃甲酸正丁酯的产率为________。实验中呋喃甲酸正丁酯的实际产率总是小于此计算值,不可能原因是_______(填字母代号)。
A.分水器收集的水里含呋喃甲酸正丁酯
B.该实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失