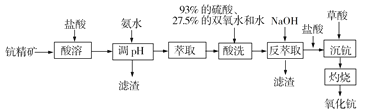
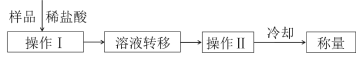
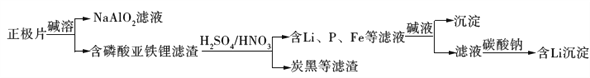
题目内容
【题目】铁及其化合物与人类生产、生活息息相关。
(1)FeCl3可用作止血剂。基态铁原子的核外电子排布式为______, Fe3+有______个未成对电子。
(2)K3[Fe(CN)6]主要应用于照相纸、颜料、制革、印刷等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
①K3[Fe(CN)6]中所涉及的元素的第一电离能由大到小的顺序_________。
②(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_________。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为________。
(3)CO能与金属Fe所形成的配合物Fe(CO)5,其熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示:

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_________。
A Fe(CO)5是非极性分子,CO是极性分子
B Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C 1mol Fe(CO)5含有10mol配位键
D 反应Fe(CO)5 = Fe+5CO没有新化学键生成
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示:
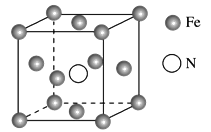
则氮化铁的化学式为________;设晶胞边长为a cm,阿伏加德罗常数的值为NA,该晶体的密度为________g·cm-3(用含a和NA的式子表示)。
【答案】[Ar]3d64s2 5 N>C>Fe>K 3:4 sp 分子 AC Fe4N ![]()
【解析】
(1)Fe原子核外电子排布为:1s22s22p63s23p63d64s2。Fe3+的核外电子排布为:1s22s22p63s23p63d5或[Ar]3d5;
(2)①金属元素第一电离能较小,非金属元素第一电离能较大,同周期自左而右元素的第一电离能呈增大趋势,ⅤA族np能级容纳3个电子,为半充满稳定状态,能量较低,第一电离能高于同周期相邻元素;
②(CN)2中的结构式为N≡C-C≡N。H-C≡N中含三键,是直线型结构;
(3)①分子晶体的熔沸点较低;
②非极性分子:正负电荷中心重合。Fe原子与5个CO形成5个配位键,在每个CO分子中存在1个配位键。Fe(CO)5=Fe+5CO断开了Fe与CO分子间的配位键,形成了金属键;
(4)用均摊法确定化学式,计算公式![]() =
=![]() 。
。
(1)Fe原子核外电子排布为:1s22s22p63s23p63d64s2。Fe原子失去4s能级上的2个电子及3d能级上的1个电子形成Fe3+,Fe3+的核外电子排布为:1s22s22p63s23p63d5或[Ar]3d5,有5个未成对电子;
(2)①同周期自左而右元素的第一电离能呈增大趋势,则第一电离能Fe>K,ⅤA族np能级容纳3个电子,为半充满稳定状态,能量较低,第一电离能高于同周期相邻元素,则N>C,金属元素第一电离能较小,非金属元素第一电离能较大,则K3[Fe(CN)6]中四种组成元素的第一电能由大到小的排序是N>C>Fe>K;
②产物(CN)2中含碳碳键,其结构式为N≡C-C≡N,σ键有3条,π键有4条,则σ键和π键数目之比为3:4。HCN分子的结构式是:H-C≡N,HCN分子中含有2个σ键和2个π键,C原子不含孤电子对,所以C的价层电子对数是2,中心原子C原子以sp杂化轨道成键;
(3)①分子晶体的熔沸点较低,根据题给信息知,Fe(CO)5的熔沸点较低,所以为分子晶体;
②A.根据Fe (CO)5的结构可知, Fe(CO)5为三角双锥结构,分子中正负电荷中心重合,是非极性分子,CO中正负电荷中心不重合,是极性分子,故A正确;
B.Fe(CO)5中Fe原子与5个CO成键,不是sp3杂化,故B错误;
C. 1molFe(CO)5中Fe原子与5molCO形成5mol配位键,在每摩CO分子中存在1mol配位键,共含有10mol配位键,故C正确;
D. Fe(CO)5=Fe+5CO属于化学变化,包括化学键的断裂与形成,断开了Fe与CO分子间的配位键,形成了金属键,故D错误;
答案选AC;
(4)1个晶胞中含氮原子个数为1,含铁原子个数为8![]() =4,则氮化铁的化学式为Fe4N。晶体的密度
=4,则氮化铁的化学式为Fe4N。晶体的密度![]() =
=![]() =
=![]() g·cm-3。
g·cm-3。

【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红 | 原Fe(NO3)2样品已变质 |
B | 向蛋白质溶液中分别加入甲醛和(NH4)2SO4饱和溶液,均有固体析出 | 蛋白质均发生了变性 |
C | 向2 mL 0.5 mol·L-1 NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液,产生白色沉淀和气体 | 白色沉淀和气体分别为CaCO3和CO2 |
D | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | 气体X一定具有强氧化性 |
A.AB.BC.CD.D