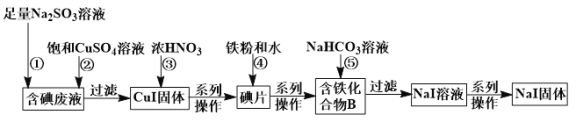
题目内容
【题目】(12分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
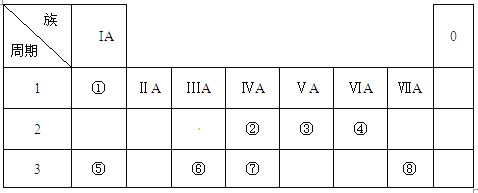
(1)④、⑤、⑥的原子半径由大到小的顺序为___________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3c.Na2SO3d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
【答案】(1)Na>Al>O (2)HNO3>H2CO3>H2SiO3 (2)![]() (4)a b
(4)a b
(5)Al3++3NH3·H2O2=Al(OH)3↓+3NH4+、2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
【解析】
由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl。则
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故④、⑤、⑥的原子半径由大到小的顺序是Na>Al>O;
(2)非金属性N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3
(3)H、O、Na、Cl中的某些元素可形成既含离子键又含极性共价键的化合物,可以是氢氧化钠或次氯酸钠,其电子式为![]() 或
或![]() ;
;
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解生成氧气和水,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,答案为ab;
(5)M是仅含非金属的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,推断N是氧化铝,Z是氢氧化铝,根据产物结合反应:X+Y+H2O→Al(OH)3+NH4+可知,该反应为铝盐和一水合氨的反应,因此X溶液与Y溶液反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,铝是活泼的金属通过电解法冶炼,则N→⑥的单质的化学方程式为2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】(1).将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度/ (×10-3mol·L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①氨基甲酸铵分解反应的焓变△H__________0(填">"或"<)
②可以判断该分解反应已经达到化学平衡的是__________(填字母);
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为__________.
(2).已知25℃时,NH3·H2O电离常数Kb=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,计算0.5mol·L-1氨水的pH约为__________(已知lg3≈0.5)。在某MgCl2溶液中加入一定量的某浓度的氨水后,测得混合液的pH=11,则此温度下残留在溶液中的c(Mg2+)=__________.