题目内容
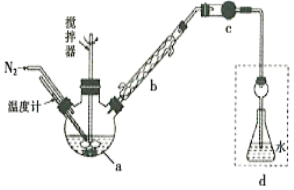
【题目】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl ![]() 2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:

回答下列问题:
(1)仪器a的名称是________,搅拌器的作用是_______。
(2)反应结束后,还要继续通入N2的目的是__________;仪器c盛装的试剂是________(填序号)。
A.碱石灰 B.浓硫酸 C.无水氯化钙 D.硅胶
(3)如何从滤液中回收过量的氯苯:_____________
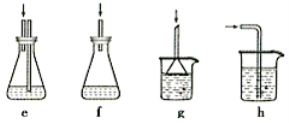
(4)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是_________(填序号)。
(5)将锥形瓶内的溶液稀释至1000mL,从中取10. 00mL,用0. 2000mol·L-1AgNO3溶液进行滴定,以K2CrO4溶液作指示剂,终点现象为______________________
【答案】三颈烧瓶或三口烧瓶 加快反应速率 将反应生成的HCl全部排至装置d,被水完全吸收 CD 蒸馏滤液,收集132℃的馏分 eg 红色沉淀刚好出现,且半分钟内不消失
【解析】
(1)观察装置图,认识仪器,结合反应在搅拌的情况下能加快反应速率分析;
(2)继续通入N2,排尽装置内的HCl,被水完全吸收,装置C作用是干燥HCl;
(3)依据表中氯苯和二氯苯的沸点,采用蒸馏法分离;
(4)虚线部分是吸收HCl的装置,HCl极易溶于水,吸收是要防止倒吸;
(5)用AgNO3溶液进行滴定盐酸,以K2CrO4溶液作指示剂,由表中数据可知,先生成氯化银沉淀,然后才会生成铬酸银红色沉淀,由此可判断滴定终点。
(1)装置中用到了三颈烧瓶,用玻璃棒搅拌的目的是,反应物充分混合,加快反应速率;
本题答案为:三颈烧瓶或三口烧瓶 , 加快反应速率。
(2)反应结束后,继续通入N2,可将产生的HCl排至d,被水完全吸收,减少实验误差,仪器C是用来干燥生成HCl,应选择固态、酸性干燥剂,可选择无水氯化钙或硅胶;
本题答案为:将反应生成的HCl全部排至装置d,被水完全吸收 ,CD。
(3)根据表中数据,氯苯和二氯苯的沸点相差很大,要从滤液中回收过量的氯苯,可选择蒸馏的方法,只要收集132![]() 的馏分即可;
的馏分即可;
本题答案为:蒸馏滤液,收集132℃的馏分。
(4)HCl极易溶于水,能防止倒吸的装置是eg,f是密封装置,气体不能通过,h装置会产生倒吸,故能代替虚线部分的是eg;
本题答案为:eg。
(5)锥形瓶内是HCl的水溶液,将锥形瓶内的溶液稀释至1000mL,从中取10. 00mL,用0. 2000mol·L-1AgNO3溶液进行滴定,以K2CrO4溶液作指示剂,由表中数据可知,先生成氯化银沉淀,然后才生成铬酸银红色沉淀,因此当刚好出现红色沉淀,且半分钟不消失,即为滴定终点;
本题答案为:红色沉淀刚好出现,且半分钟内不消失。