��Ŀ����
����Ŀ����NOxΪ��Ҫ�ɷֵ��������ۺ������ǵ�ǰ��Ҫ���о����⡣
(1) N2O��һ��ǿ�������壬�����γɿ�������Ⱦ��о�N2O�ķֽ�Ի�����������Ҫ���塣�����������ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
��һ��I2(g)��2I(g)(�췴Ӧ)
�ڶ���I(g)+N2O(g)��N2(g)+IO(g)(����Ӧ)
������IO(g)+N2O(g)��N2(g)+O2(g)+I2(g)(�췴Ӧ)
ʵ�����������ʱN2O�ֽ����ʷ���v=k��c(N2O)��[c(I2)]0.5(kΪ���ʳ���)�����б�����ȷ����__________��
A��N2O�ֽⷴӦ�У��ֽ��������Ƿ������й� B�����������ܷ�Ӧ�������������
C���ڶ�����ܱȵ�����С D��IOΪ��Ӧ�Ĵ���
(2)����β���к��н϶�ĵ�������Ͳ���ȫȼ�յ�CO��������Ԫ��������ʵ�ֽ��͵���������ŷ���������β���е�NO(g)��CO(g)�ڴ�����������ת������������Ⱦ�����塣�磬
��ӦI��2CO +2NO �� N2+2CO2 ��H1�� ��ӦII��4CO +2NO2 �� N2+4CO2 ��H2<0��
��Է�ӦI:����֪����ӦN2(g)+O2(g)=2NO(g) ��H3=+180.0kJ��mol1����CO��ȼ����Ϊ-283.5kJ��moll ��ӦI�ġ�H1=_________kJ��mol1��
�����ں��ݵ��ܱ������У�����2molCO��1molNO��������ӦI������ѡ���в���˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����_______��
A.CO��NO�����ʵ���֮�Ȳ��� B.���������ܶȱ��ֲ���
C.��������ѹǿ���ֲ��� D.2v��N2����=v��CO����
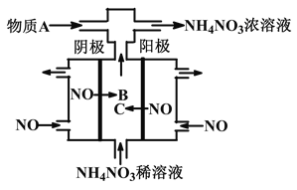
��3������ԭ���ԭ���͵��ԭ��������ͼ�ش���ش� ����ͼ��ʾװ�ý���ʵ��(K�պ�)��
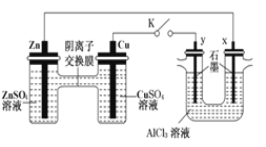
��Zn��Ϊ________����ʵ������У�SO42-________(������������������������������������)�ƶ���
��y���ĵ缫��Ӧ����Ϊ________��
��д�������жԸ�բ�ŵ�һ�ֵ绯ѧ��������________________________��
����������Ѱ����ʵĴ����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HClNH4ClΪ�������Һ��ȡ����ȼ�ϵ�أ���д���õ�ص�������Ӧʽ______________________��
���𰸡�A -747.0 B �� �������� �л���ɫ�������� ������������������������ӵ��������������� N2+6e-+8H+= 2NH4+
��������
(1) A������ɸ�����Ϣ�������������ܴ�������N2O�ķֽ����ʣ���A��ȷ��
B���ڶ�����ӦΪ����Ӧ�����ܷ�Ӧ��������������ã���B����
C���ڶ�����ӦΪ����Ӧ����������ӦΪ�췴Ӧ���ڶ�����ܱȵ�������C����
D�����������뻯ѧ��Ӧ����Ӧ����ʱ�������Ա���ԭ�������ʣ����ݵڶ����͵������ķ�ӦIO���м�����D����
��ѡA��
(2) �ٸ�����֪������N2(g)+O2(g)=2NO(g) ��H3=+180.0kJ��mol1����2CO(g)+O2(g)=2CO2(g) ��H4=-567kJ��moll�����ݸ�˹���ɣ���-�ٵ�2CO(g) +2NO(g)=N2(g)+2CO2(g) ��H1=-747.0kJ��mol1��
����-747.0��
��A.���ﵽƽ��ʱ����ϵ�ڸ���ֵĺ������ֲ����״̬��CO��NO�����ʵ���֮�Ȳ��䣬��Ϊ CO��NO�����ʵ������ֲ��䣬��A��ȷ��
B. ��ӦIΪ��������ϵ����Ӧǰ���������������ֲ��䣬���������£�����������ʼ�ղ��䣬���������ܶ�ʼ�ձ��ֲ��䣬�����жϷ�Ӧ�ﵽƽ�⣬��B����
C.��ӦI��Ӧ�Ⱥ����������С����ϵ����Ӧ����ϵ����ѹǿ��С������������ѹǿ���ֲ��䣬����˵����Ӧ�ﵽƽ�⣬��C��ȷ��
D.v��N2������v��CO����= 1:2����ͬ�������淴Ӧ����֮�ȵ��ڼ���ϵ��֮�ȣ���Ӧ�ﵽƽ��״̬����D��ȷ��
��ѡB��
(3) �������ԭ��أ�����п�Ǹ�����ͭ��������������������������������������
�ʴ�Ϊ��������������
���Ҷ��ǵ��أ�y������������������ʧ���ӵ�������Ӧ���л���ɫ�����������ɣ�ͭ�缫��������������ԭ��Ӧ��Cu2++2e=Cu��
�ʴ�Ϊ���л���ɫ�������ɣ�
��д�������жԸ�բ�ŵ�һ�ֵ绯ѧ��������������բ������Ƕ�������õĽ��������������������������������բ��ͨ�罫��բ�����Դ��������������ӵ���������������
�ʴ�Ϊ��������������������������ӵ�����������������
����N2��H2Ϊ�缫��Ӧ���HClNH4ClΪ�������Һ��ȡ����ȼ�ϵ�أ�N2������������ԭ��Ӧ����NH4+���缫��ӦʽΪN2+6e-+8H+= 2NH4+��
�ʴ�Ϊ��N2+6e-+8H+= 2NH4+��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
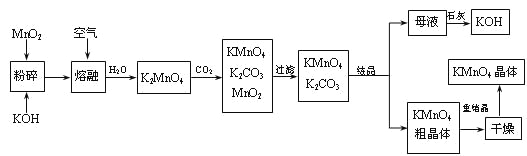
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ˮ�ܿ���Ҫ�ɷ�ΪCo2O3��������Fe2O3��A12O3��MnO��MgO��CaO��SiO2�ȣ�������ȡ���ֻ����Լ�������Ϊ�����ܾ�����Ȼ��ܾ�����Ʊ����̣��ش��������⣺
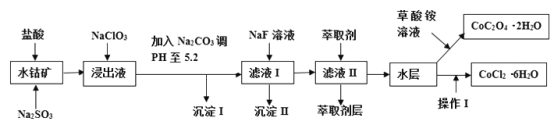
��֪���ٽ���Һ�к��е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Al3+��Mg2+��Ca2+�ȣ��ڳ���I��ֻ�������ֳ������������в���������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��1������������Co2O3������Ӧ�����ӷ�Ӧ����ʽΪ_________________��
��2��NaClO3�ڽ���Һ�з��������ӷ�Ӧ����ʽΪ______________��
��3������Na2CO3��PH��5.2��Ŀ����________����ȡ���㺬��Ԫ�أ������II����Ҫ�ɷ�Ϊ_____��
��4������I��������ˮ�����Ũ�������PHΪ2-3��______��_____�����ˡ�ϴ�ӡ���ѹ��ɵȹ��̡�
��5��Ϊ�ⶨ�ֲ�Ʒ��CoCl2��6H2O��������ȡһ�������Ĵֲ�Ʒ����ˮ���������������ữ����������Һ�����ˡ�ϴ�ӡ���������������ͨ�����㷢�ֲִ�Ʒ��CoCl2��6H2O������������100%,��ԭ�������_____���ش�һ��ԭ�ɣ���
����Ŀ��̼���仯�����й㷺Ӧ�á�
��1����ҵұ��������ʯīΪ������������ӦʽΪ________�����ܷ�������Ӧ��_______��
��2��һ����̼�Ϳ��������Խ����й���ȼ�ϵ�أ�������ӦʽΪ___________��
��3����75 mL 4 molL-1KOH��Һ�л���ͨ��4480 mL CO2���壨��״����ǡ����ȫ�����ա�
��д���÷�Ӧ�����ӷ���ʽ��___________________________��
�ڸ�������Һ������Ũ�ȴ�С����Ϊ_________________________��
�۳����£�a molL-1KHCO3��Һ��pH=8��HCO3��ˮ�ⳣ��Լ����__________�����ú�aʽ��ʾ����
��4����֪���� 2H2(g)+O2(g)=2H2O(l) ��H1= ��571.6kJmol-1
�� 2CO(g)+O2(g)=2CO2(g) ��H2 = ��566.0kJmol-1
�� CO(g)+2H2(g)![]() CH3OH(g) ��H3 = ��90.8kJmol-1
CH3OH(g) ��H3 = ��90.8kJmol-1
����״�������ȼ���ȡ�H��_______________��
��5��ij�¶��£��������淴Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H��-41.0kJ/mol����ij�����г���1.0 molH2��1.0 mol(g)����һ�������·���������Ӧ�����������CO�����ʵ�����ʱ���ϵ��������ʾ��
CO2(g)��H2(g) ��H��-41.0kJ/mol����ij�����г���1.0 molH2��1.0 mol(g)����һ�������·���������Ӧ�����������CO�����ʵ�����ʱ���ϵ��������ʾ��
0 | 5 min | 10 min | 15 min | 20 min | 25 min | |
I(800��) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
II(800��) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
���ʵ��I��ʵ��II���ܸı������������________�����¶��£�ƽ�ⳣ��=_______��