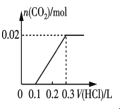
题目内容
【题目】[化学-选修5:有机化学基础]有机化合物F是一种重要的有机合成中间体,其合成路线如下图所示:

已知:①A的核磁共振氢谱图中显示两组峰②F的结构简式为:

③通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
④![]()
请回答下列问题:
(1)A的名称为______________(系统命名法);Z中所含官能团的名称是___________。
(2)反应Ⅰ的反应条件是__________;反应Ⅲ的反应类型为__________ 。
(3)E的结构简式为_______________________。
(4)写出反应Ⅴ的化学方程式____________________________________________。
(5)写出反应IV中的化学方程式____________________________________________。
(6)W是Z的同系物,相对分子质量比Z大14,则W的同分异构体中满足下列条件:
①能发生银镜反应,②苯环上有两个取代基,③不能水解,遇FeCl3溶液不显色的结构共有_________种(不包括立体异构),核磁共振氢谱有四组峰的结构为____________。
【答案】2-甲基-2-丙醇 酚羟基、醛基 浓硫酸,加热 氧化反应 (CH3)2CHCOOH 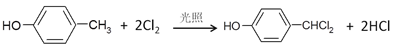 (CH3)2CHCHO+2Cu(OH)2
(CH3)2CHCHO+2Cu(OH)2![]() (CH3)2CHCOOH+Cu2O+2H2O 6
(CH3)2CHCOOH+Cu2O+2H2O 6 ![]()
【解析】
A的分子式为C4H10O,A的核磁共振氢谱图中显示两组峰,所以A的结构简式为:(CH3)3C(OH);比较A、B的分子式可以知道,A→B是消去反应,所以B是(CH3)2C=CH2,B→C是加成反应,根据提供的反应信息,C是(CH3)2CHCH2OH;C→D是氧化反应,D是(CH3)2CHCHO,D→E是氧化反应,所以E是(CH3)2CHCOOH;X的分子式为C7H8O,且结合E和F的结构简式可知,X的结构简式为![]() ;在光照条件下与氯气按物质的量之比1:2反应,是对甲酚中的甲基中的2个H被Cl取代,因此Y的结构简式为
;在光照条件下与氯气按物质的量之比1:2反应,是对甲酚中的甲基中的2个H被Cl取代,因此Y的结构简式为![]() ,Y→Z是水解反应,根据信息③,应该是-CHCl2变成-CHO,则Z的结构简式为
,Y→Z是水解反应,根据信息③,应该是-CHCl2变成-CHO,则Z的结构简式为![]() ,Z→F是酯化反应,F的结构简式为:
,Z→F是酯化反应,F的结构简式为: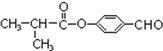 ;据以上分析解答。
;据以上分析解答。
A的分子式为C4H10O,A的核磁共振氢谱图中显示两组峰,所以A的结构简式为:(CH3)3C(OH);比较A、B的分子式可以知道,A→B是消去反应,所以B是(CH3)2C=CH2,B→C是加成反应,根据提供的反应信息,C是(CH3)2CHCH2OH;C→D是氧化反应,D是(CH3)2CHCHO,D→E是氧化反应,所以E是(CH3)2CHCOOH;X的分子式为C7H8O,且结合E、F的结构简式可知,X的结构简式为![]() ,在光照条件下与氯气按物质的量之比1:2反应,是对甲酚中的甲基中的2个H被Cl取代,因此Y的结构简式为
,在光照条件下与氯气按物质的量之比1:2反应,是对甲酚中的甲基中的2个H被Cl取代,因此Y的结构简式为![]() ;Y→Z是水解反应,根据信息③,应该是-CHCl2变成-CHO,则Z的结构简式为
;Y→Z是水解反应,根据信息③,应该是-CHCl2变成-CHO,则Z的结构简式为![]() ,Z→F是酯化反应,F的结构简式为:
,Z→F是酯化反应,F的结构简式为: ;
;
(1)结合以上分析可知,A的结构简式为:(CH3)3C(OH),名称为2-甲基-2-丙醇;Z的结构简式为:![]() ,所含官能团酚羟基、醛基;综上所述,本题答案是:2-甲基-2-丙醇;酚羟基、醛基。
,所含官能团酚羟基、醛基;综上所述,本题答案是:2-甲基-2-丙醇;酚羟基、醛基。
(2) A为(CH3)3C(OH),B为(CH3)2C=CH2,A→B是消去反应,反应Ⅰ的反应条件是浓硫酸加热;C是(CH3)2CHCH2OH, D是(CH3)2CHCHO,所以C→D是在铜作催化剂条件下发生的氧化反应;综上所述,本题答案是:浓硫酸,加热;氧化反应。
(3)结合以上分析可知,E的结构简式为(CH3)2CHCOOH;综上所述,本题答案是:(CH3)2CHCOOH。
(4) ![]() 在光照条件下与氯气按物质的量之比1:2反应,是对甲酚中的甲基中的2个H被Cl取代,生成
在光照条件下与氯气按物质的量之比1:2反应,是对甲酚中的甲基中的2个H被Cl取代,生成 ![]() ,反应Ⅴ的化学方程式:
,反应Ⅴ的化学方程式: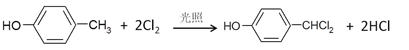 ;综上所述,本题答案是:
;综上所述,本题答案是: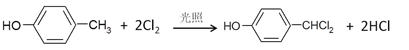 。
。
(5) D是(CH3)2CHCHO,在氢氧化铜悬浊液中加热,发生银镜反应,反应IV中的化学方程式(CH3)2CHCHO+2Cu(OH)2![]() (CH3)2CHCOOH+Cu2O+2H2O;综上所述,本题答案是:(CH3)2CHCHO+2Cu(OH)2
(CH3)2CHCOOH+Cu2O+2H2O;综上所述,本题答案是:(CH3)2CHCHO+2Cu(OH)2![]() (CH3)2CHCOOH+Cu2O+2H2O。
(CH3)2CHCOOH+Cu2O+2H2O。
(6) Z的结构简式为![]() ,W是Z的同系物,相对分子质量比Z大14,W分子式为C8H8O2,W的同分异构体中满足下列条件:①能发生银镜反应,含有醛基;②苯环上有两个取代基,可以3种位置;③不能水解,遇FeCl3溶液不显色,没有酯基,酚羟基;满足条件下的结构有:苯环上分别连有-CHO和-CH2OH,结构有3种;苯环上分别连有-CHO和-OCH3,结构有3种;共计有6种;其中核磁共振氢谱有四组峰的结构为:
,W是Z的同系物,相对分子质量比Z大14,W分子式为C8H8O2,W的同分异构体中满足下列条件:①能发生银镜反应,含有醛基;②苯环上有两个取代基,可以3种位置;③不能水解,遇FeCl3溶液不显色,没有酯基,酚羟基;满足条件下的结构有:苯环上分别连有-CHO和-CH2OH,结构有3种;苯环上分别连有-CHO和-OCH3,结构有3种;共计有6种;其中核磁共振氢谱有四组峰的结构为:![]() ;综上所述,本题答案是:6,
;综上所述,本题答案是:6,![]() 。
。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案