题目内容
【题目】请按要求回答下列问题:
(1)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是不溶物氢氧化铝。其治疗原理是(用离子方程式表示)_______。
(2)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是_______。
(3)反应2H2CrO4+3H2O2=2Cr(OH)3 +3O2↑+2H2O中H2O2的变化过程为H2O2→O2。
①该反应的还原剂是________(填化学式)。
②在该反应方程式中用双线桥法标明电子转移的方向和数目。________
2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
③若反应中转移了3mol电子,则产生的气体在标准状况下体积为_______L。
【答案】Al(OH)3+3H+=Al3++3H2O Al2O3+3Cl2+3C![]() 2AlCl3 +3CO H2O2
2AlCl3 +3CO H2O2 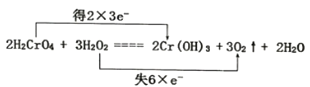 33.6
33.6
【解析】
(1)氢氧化铝与盐酸反应产生氯化铝和水;
(2)Al2O3与C、Cl2在高温条件下反应,生成AlCl3和CO;
(3)根据元素化合价升高,失去电子,被氧化,物质作还原剂;元素化合价降低,获得电子,被还原,物质作氧化剂,氧化剂获得电子总数与还原剂失去电子总数相等,等于反应过程中元素化合价升降总数,据此分析解答。
(1)氢氧化铝与盐酸反应产生氯化铝和水,用离子方程式表示为:Al(OH)3+3H+=Al3++3H2O;
(2) Al2O3与C、Cl2在高温条件下反应,生成AlCl3和CO,根据电子守恒、原子守恒,可得该反应的方程式为:Al2O3+3Cl2+3C![]() 2AlCl3 +3CO;
2AlCl3 +3CO;
(3)①在反应2H2CrO4+3H2O2=2Cr(OH)3 +3O2↑+2H2O中,Cr元素的化合价由反应前H2CrO4中的+6价变为反应后Cr(OH)3 中的+3价,化合价降低,获得电子2×3e-,被还原,H2CrO4作氧化剂;O元素的化合价由反应前H2O2中的-1价变为反应后O2中的0价,化合价升高,失去电子6×e-,H2O2作还原剂;
②根据①分析,反应过程中电子转移用线桥法标明电子转移的方向和数目为 ;
;
③在反应2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O中,每转移6mol电子,反应会产生3molO2,则反应中转移了3mol电子,产生1.5molO2,产生的O2气体在标准状况下体积V(O2)=1.5mol×22.4L/mol=33.6L。

 黄冈小状元解决问题天天练系列答案
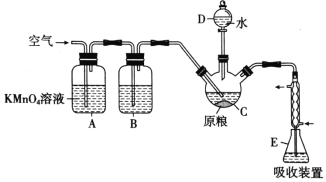
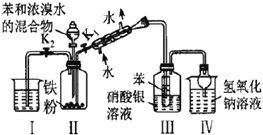
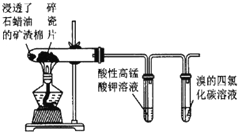
黄冈小状元解决问题天天练系列答案【题目】下列实验所用试剂、现象和结论均正确的是
选项 | 实验装置 | 现象 | 结论 |
A |
| 装置Ⅲ中有浅黄色沉淀 | 苯和浓溴水发生取代反应 |
B |
| 高锰酸钾溶液褪色,溴的四氯化碳溶液褪色 | 石蜡油的分解产物中含有不饱和烃 |
C |
| 盛有饱和碳酸钠溶液的试管中,上方出现油状液体 | 制备乙酸乙酯 |
D |
| 甲醚有气泡 | 鉴别乙醇与甲醚(CH3OCH3) |
A. A B. B C. C D. D