题目内容
【题目】碳及其化合物有广泛应用。
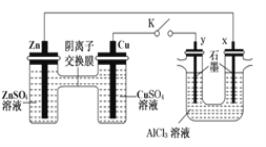
(1)工业冶炼铝,以石墨为阳极。阳极反应式为________,可能发生副反应有_______。
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为___________。
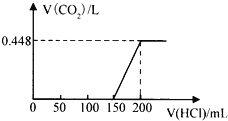
(3)向75 mL 4 molL-1KOH溶液中缓慢通入4480 mL CO2气体(标准状况)恰好完全被吸收。
①写出该反应的离子方程式:___________________________。
②该吸收溶液中离子浓度大小排序为_________________________。
③常温下,a molL-1KHCO3溶液的pH=8,HCO3的水解常数约等于__________。(用含a式表示)。
(4)已知:① 2H2(g)+O2(g)=2H2O(l) △H1= —571.6kJmol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 = —566.0kJmol-1
③ CO(g)+2H2(g)![]() CH3OH(g) △H3 = —90.8kJmol-1
CH3OH(g) △H3 = —90.8kJmol-1
计算甲醇蒸气的燃烧热△H=_______________。
(5)某温度下,发生可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.0kJ/mol,向某容器中充入1.0 molH2和1.0 mol(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
CO2(g)+H2(g) △H=-41.0kJ/mol,向某容器中充入1.0 molH2和1.0 mol(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
0 | 5 min | 10 min | 15 min | 20 min | 25 min | |
I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
II(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验I,实验II可能改变的条件可能是________,该温度下,平衡常数=_______。
【答案】2O2-4e=O2↑ C+O2![]() CO2(或2C+O2
CO2(或2C+O2![]() 2CO) CO - 2e+H2O=CO2+2H 2CO2+3OH=CO32+HCO3+H2O c(K)>c(HCO3)>c(CO32)>c(OH)>c(H)
2CO) CO - 2e+H2O=CO2+2H 2CO2+3OH=CO32+HCO3+H2O c(K)>c(HCO3)>c(CO32)>c(OH)>c(H) ![]() -763.8 kJmol-1 增大压强(或缩小体积)、加催化剂 1
-763.8 kJmol-1 增大压强(或缩小体积)、加催化剂 1
【解析】
(1)电解氧化铝得到铝和氧气,阳极上氧离子失去电子发生氧化反应,电极反应式:2O2--4e-=O2↑;生成的氧气在高温下氧化石墨电极,发生的反应有C+O2![]() CO2(或2C+O2
CO2(或2C+O2![]() 2CO)
2CO)
故答案为:2O2--4e-=O2↑;C+O2![]() CO2(或2C+O2
CO2(或2C+O2![]() 2CO)
2CO)
(2)在酸性介质中CO氧化生成CO2,负极反应式为CO-2e-+H2O=CO2+2H+,
故答案为:CO-2e-+H2O=CO2+2H+;
(3)n(KOH)=0.075L×4molL-1=0.3mol,n(CO2)=![]() =0.2mol,因为二者恰好反应,则反应的离子方程式为2CO2+3OH-=CO32-+HCO3-+H2O,
=0.2mol,因为二者恰好反应,则反应的离子方程式为2CO2+3OH-=CO32-+HCO3-+H2O,
故答案为:2CO2+3OH-=CO32-+HCO3-+H2O;
②因为碳酸根水解程度大于碳酸氢根,并且水解后都成碱性,所以离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
③因为amolL-1KHCO3溶液的pH=8,所以c(OH-)=10-6mol/L,HCO3-+H2OH2CO3+OH-,c(OH-)=c(H2CO3)=10-6mol/L,水解程度小,消耗HCO3-可忽省不计,所以K=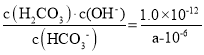 =
=![]() ;
;
故答案为:![]() ;/span>
;/span>
(4)①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJmol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJmol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJmol-1
根据盖斯定律知,①+②×![]() -③得:CH3OH(g)+
-③得:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-571.6kJmol-1-566.0kJmol-1×
O2(g)=CO2(g)+2H2O(l)△H=-571.6kJmol-1-566.0kJmol-1×![]() +90.8kJmol-1=-763.8kJmol-1,
+90.8kJmol-1=-763.8kJmol-1,
故答案为:-763.8kJmol-1;
(5)从数据看,I和II达到相同状态,说明平衡没有移动,若该可逆反应是等气体分子数反应,且反应物和产物都是气态,增大压强,平衡不移动,能缩短达到平衡的时间;加入催化剂也能加快反应速率,缩短达到平衡时间;等气体分子数反应,可以用物质的量代替浓度计算平衡常数,达到平衡时,各物质的物质的量都等于0.5mol,所以K=![]() =1,
=1,
故答案为:增大压强(或缩小体积)、加催化剂;1;

【题目】下列实验所用试剂、现象和结论均正确的是
选项 | 实验装置 | 现象 | 结论 |
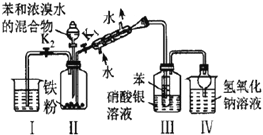
A |
| 装置Ⅲ中有浅黄色沉淀 | 苯和浓溴水发生取代反应 |
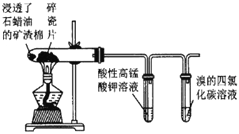
B |
| 高锰酸钾溶液褪色,溴的四氯化碳溶液褪色 | 石蜡油的分解产物中含有不饱和烃 |
C |
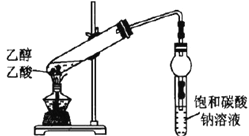
| 盛有饱和碳酸钠溶液的试管中,上方出现油状液体 | 制备乙酸乙酯 |
D |
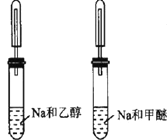
| 甲醚有气泡 | 鉴别乙醇与甲醚(CH3OCH3) |
A. A B. B C. C D. D