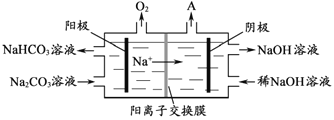
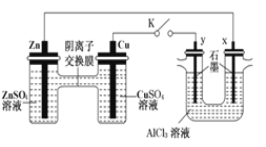
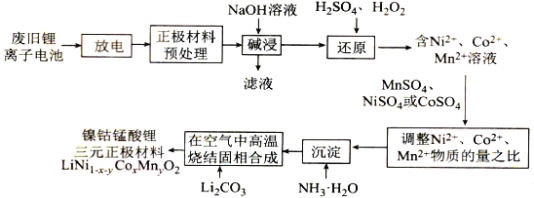
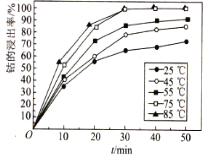
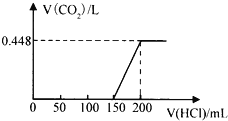
题目内容
【题目】下列反应的现象描述与离子方程式都正确的是( )
A.金属镁与稀盐酸反应:有气泡逸出Mg+2H++2Cl-=MgCl2+H2↑
B.氯化钡溶液与稀硫酸反应:有白色沉淀生成 Ba2++SO42—=BaSO4↓
C.碳酸钠溶液与盐酸反应:有气泡逸出 Na2CO3+2H+=2Na++CO2↑+H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生2HCO![]() +Ba2++2OH-===BaCO3↓+2H2O+CO32—
+Ba2++2OH-===BaCO3↓+2H2O+CO32—
【答案】B
【解析】
A. 金属镁与稀盐酸反应生成氯化镁和氢气,有气泡逸出,反应的离子方程式是Mg+2H+=Mg2++H2↑,故A错误;
B. 氯化钡溶液与稀硫酸反应生成硫酸钡沉淀和盐酸,反应的离子方程式是 Ba2++SO42—=BaSO4↓,故B正确;
C. 碳酸钠溶液与盐酸反应生成氯化钠、二氧化碳、水,有气泡逸出,反应的离子方程式是 CO32-+2H+=CO2↑+H2O,故C错误;
D. NaHCO3溶液中加入过量的Ba(OH)2溶液生成碳酸钡沉淀、氢氧化钠、水,反应的离子方程式是HCO![]() +Ba2++OH-===BaCO3↓+H2O,故D错误。
+Ba2++OH-===BaCO3↓+H2O,故D错误。
选B。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)