题目内容
常温下,下列离子能使纯水中的H+离子数目增加的是 ( )
| A.S2- | B.CO32- | C.NH4+ | D.Br- |
C
解析试题分析:A.S2-水解消耗水电离产生的H+,使溶液中H+的浓度减小,错误;B.CO32-水解消耗水电离产生的H+,使溶液中H+的浓度减小,错误;C.NH4+水解消耗水电离产生的OH-,使溶液中H+的浓度减增大,正确;D.Br-是强酸的酸根离子,不发生水解反应,对水的电离平衡无影响,错误。
考点:考查盐的水解及溶液的离子浓度的大小的知识。

练习册系列答案
相关题目
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
| 实验编号 | 温度 | 时间 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |
(1)开展实验1和实验2的目的是 。
(2)180℃时,反应到40min,体系 (填“是”或“否”)达到平衡状态,理由是 ;CH4的平衡转化率为 。
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。

(5)根据已知求算:ΔH2= 。
CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2 下面是某研究小组研究的关于不同催化剂对H2O2分解反应的催化效率。
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml) | 5 | 11 | 7 | 8 | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
(1)写出H2O2在催化剂作用下分解反应的化学方程式________________________
(2)从上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是_____________________,
等质量的固体催化剂,颗粒大小对催化效率有什么影响______________________
(3)实验发现新鲜的动物肝脏对H2O2的分解也有显著的催化作用,但当往溶液中加入
盐酸,或给溶液加热时,就会失去催化能力,合理的解释是
(4)对于FeCl3的催化作用,有人认为是Fe3+起催化作用,有人认为是Cl-,请你设计一
个实验进行验证。_______________________________________________________
下列叙述或表示正确的是
| A.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=b |
| B.用200 mL 4 mol·L-1的NaOH溶液将0.6 mol CO2完全吸收,反应的离子方程式为: 3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O |
| C.难溶电解质AB2的饱和溶液中,c(A2+)=xmol·L-1, c(B-)="y" mol·L-1,则Ksp值为4xy2 |
| D.常温下0.1 mol·L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中: |
常温下,pH = 12的NaOH溶液与pH =1的HC1溶液按一定比例混合,所得溶液pH =2,则NaOH溶液与HC1溶液的体积比为
| A.9:2 | B.2:9 | C.1:9 | D.10:1 |
下列实验事实所得出的结论中,错误的是( )
| A.向AgCl沉淀中滴入稀KI溶液白色沉淀变黄,说明AgI比AgCl更难溶 |
| B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32- |
| C.先加入盐酸无沉淀,再加入BaCl2溶液产生白色沉淀,则试样中一定有SO42- |
| D.盐溶液中加入NaOH微热,产生使湿润的红色石蕊试纸变蓝的气体,则一定是铵盐 |
(原创)已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是
| A.对比等浓度的两种酸的pH |
| B.对比等浓度的两种酸,与相同大小镁条反应的初始速率 |
| C.对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量 |
| D.对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积 |
下列说法正确的是
A.将25℃纯水加热至95℃时,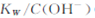 增大 增大 |
B.将pH=11的Na2CO3溶液加水稀释, 增大 增大 |
| C.室温下,pH=a的盐酸与pH=b的氨水等体积混合后pH=7,则a+b="14" |
| D.0.1mol·L-酸HA与0.1mol·L-NaOH溶液等体积混合后pH>7,则 |
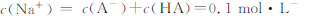
在0.1 mol/L的Na2CO3溶液中,下列关系正确的是( )
A.c(Na+)=2c(CO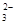 ) ) | B.c(OH-)=2c(H+) |
C.c(HCO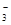 )>c(H2CO3) )>c(H2CO3) | D.c(Na+)<c(CO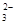 )+c(HCO )+c(HCO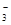 ) ) |