题目内容
下列叙述或表示正确的是
| A.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=b |
| B.用200 mL 4 mol·L-1的NaOH溶液将0.6 mol CO2完全吸收,反应的离子方程式为: 3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O |
| C.难溶电解质AB2的饱和溶液中,c(A2+)=xmol·L-1, c(B-)="y" mol·L-1,则Ksp值为4xy2 |
| D.常温下0.1 mol·L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中: |
B
解析试题分析:A.醋酸是若电解质,浓度越小,电离程度就越大,所以0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1>b, 错误;B.n(NaOH)=0.8mol;n(CO2)="0.6mol;" n(NaOH) :n(CO2)= =4:3;所以反应的离子方程式是 3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O,正确;C.难溶电解质AB2的饱和溶液中,c(A2+)=xmol·L-1, c(B-)="y" mol·L-1,则Ksp值为xy2,错误;D.常温下0.1 mol·L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)="0.05" mol/L,错误。
考点:考查溶液的酸碱性、离子浓度的大小比较的知识。

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
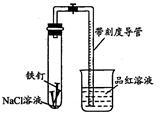
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | | |
| 2 | 20 | FeCl3溶液 | | |
| 3 | 20 | MnO2 | | |
| 4 | 20 | 无 | | |
试回答:实验1、2研究的是其他条件相同时 对H2O2分解速率的影响。
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
① 定性分析:如图甲可通过观察________________________________,定性比较得出结论。
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________。
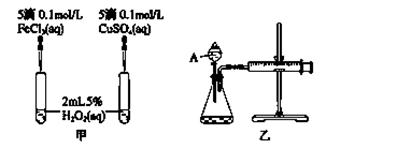
②定量分析:为了更精确地研究浓度对反应速率的影响,利用乙图装置进行定量实验。完成该实验应该测定的实验数据是____________________________________________。
常温下,在0.1mol/L的碳酸钠溶液中,下列离子浓度的关系式正确的是
A.2c(H2CO3)+c(HCO )+c(H+) = c(OH-) )+c(H+) = c(OH-) |
B.c(Na+) = c(HCO )+c(H2CO3)+ 2c(CO )+c(H2CO3)+ 2c(CO ) ) |
C.c(Na+)>c(H+)>c(OH-)>c(CO ) ) |
D.c(Na+)+c(H+) = c(HCO )+c(OH-)+ 2c(CO )+c(OH-)+ 2c(CO ) ) |
常温下,下列离子能使纯水中的H+离子数目增加的是 ( )
| A.S2- | B.CO32- | C.NH4+ | D.Br- |
下列表述中,合理的是( )
| A.将水加热,Kw不变,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
常温时,将等质量的AgCl固体分别加入到等体积的下列4种溶液中,AgCl溶解最少的是
| A.1 mol/L的AlCl3溶液 | B.2mol/L的NaCl溶液 |
| C.1.4mol/L的BaCl2溶液 | D.1mol/L的MgCl2溶液 |
已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
| A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4 |
| B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 |
| C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) =4.4×10-2 |
| D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6 mol·L-1 |
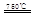 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg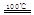 HgBr2+H2
HgBr2+H2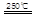 _____ + ④2HgO
_____ + ④2HgO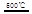 2Hg+O2↑
2Hg+O2↑ CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0