题目内容
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
| 实验编号 | 温度 | 时间 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |
(1)开展实验1和实验2的目的是 。
(2)180℃时,反应到40min,体系 (填“是”或“否”)达到平衡状态,理由是 ;CH4的平衡转化率为 。
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
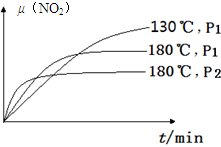
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。

(5)根据已知求算:ΔH2= 。
CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2
(16分)有效数字错误或无单位运算或无作答,总扣1分
(1)研究温度对该化学平衡的影响(2分)
(2)是(1分) 温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态。可确定40min时反应已经达平衡状态(2分) 70%(2分)
(3) CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
起始浓度(mol/L): 0.5 n 0 0 0
变化浓度(mol/L): 0.40 0.80 0.40 0.40 0.80
平衡浓度(mol/L): 0.10 n-0.80 0.40 0.40 0.80 (2分)
则: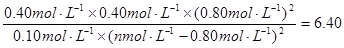 ,解得a=1.2
,解得a=1.2
答:a的值为1.2 (2分)
(4)
(2分,无标注扣1分)
(5)?1160kJ/mol(3分)
解析试题分析:(1)控制变量进行探究才能尽快得出合理结论,依题意可知,实验1和2的研究目的是温度对化学平衡的影响,其他条件保持不变,仅仅反应温度分别为130℃、180℃;(2)130℃时,反应到40min时甲烷的物质的量保持不变,说明已达平衡,升高温度,反应速率增大,达到平衡的时间缩短,则180℃时,反应到40min,体系一定达到平衡状态;由于平衡时甲烷的物的量保持不变,读表可知平衡时甲烷为0.15mol,由于起始时甲烷为0.50mol,则甲烷的平衡转化率=(0.50—0.15)mol/0.50mol×100%=70%;(3)根据表中数据,130℃时:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
起始浓度(mol/L) 0.5 n 0 0 0
变化浓度(mol/L) 0.4 0.8 0.4 0.4 0.8
平衡浓度(mol/L) 0.1 n—0.8 0.4 0.4 0.8
则130℃时该反应的K=[c(N2)×c(CO2)×c2(H2O)]/[c(CH4)×c2(NO2)]=(0.4×0.4×0.82)/[0.1×(n—0.8)2]=6.4, 解得:n=1.2;
(4)180℃、P1变为180℃、P2,就是增大压强,则反应速率增大,平衡左移,二氧化氮的平衡转化率减小,因为正反应是气体体积增大的反应;画图要点为:①起点与180℃、P1时相同;②未达平衡前,180℃、P2时曲线位于180℃、P1时曲线的左边;③180℃、P2时达到平衡的时间小于180℃、P1时;④平衡时,180℃、P2时曲线位于180℃、P1时曲线的下边;
(5)CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1,由于系数加倍焓变也加倍,则2CH4(g)+4NO2(g)
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1,由于系数加倍焓变也加倍,则2CH4(g)+4NO2(g) 2N2(g)+2CO2(g)+4H2O(g) ΔH=?2×867 kJ·mol-1,由于CH4(g)+4NO2(g)
2N2(g)+2CO2(g)+4H2O(g) ΔH=?2×867 kJ·mol-1,由于CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1,根据盖斯定律,前者减去后者可得CH4(g)+4NO(g)
4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1,根据盖斯定律,前者减去后者可得CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g),且焓变等于?1160kJ/mol,故ΔH2=?1160kJ/mol。
2N2(g)+CO2(g)+2H2O(g),且焓变等于?1160kJ/mol,故ΔH2=?1160kJ/mol。
考点:考查化学反应原理大题,涉及控制变量实验、温度对化学平衡的影响、平衡转化率的计算、根据平衡常数求反应物的起始量、压强对化学反应速率和化学平衡的影响图像、盖斯定律、热化学方程式等。

工业制硫酸时,利用催化氧化反应将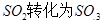 是一个关键的步骤。
是一个关键的步骤。
(1)某温度下,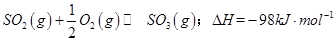 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
(2)一定条件下,向一带活塞的密闭容器中充入2mol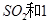 mol
mol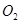 ,发生反应:
,发生反应: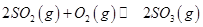 ,达平衡后改变下述条件,
,达平衡后改变下述条件,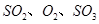 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。
A.保持温度和容器体积不变,充入2mol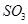 |
| B.保持温度和容器体积不变,充入2molN2 |
C.保持温度和容器内压强不变,充入1mol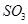 |
| D.移动活塞压缩气体 |
(3)下列关于
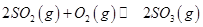 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。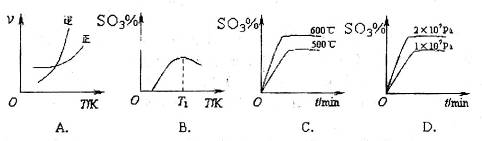
(4)同学们学习了电化学知识后大家提出,可以用电解的方法来生产硫酸,可避免产生酸雨,污染环境。于是大家设计了一个以铂为电极,两极分别通入SO2和空气,酸性电解液来实现电解生产硫酸。
①阳极的电极反应为______________________________。
②若电解液为2L0.025mol
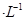 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。 ③设计此实验的想法得到了老师的充分肯定,但与工业上生产硫酸相比还是有很多不足,请对此实验进行合理的评价____________________________(写出一点即可)。
(16分)某小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,倒入大试管中迅速振荡混合均匀,再加入硫酸,开始计时,通过测定混合溶液褪色所需时间来判断反应的快慢(已知反应方程式为:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)。该小组设计了如下方案。
| 编号 | H2C2O4溶液 | KMnO4溶液 | 硫酸溶液 | 温度/℃ | ||
| | 浓度 (mol/L) | 体积 (mL) | 浓度 (mol/L) | 体积 (mL) | | |
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 50 |
(2)该小组同学由此实验发现反应进行一些时间后,有一时间段反应速率不断加快。同学们分析除了反应放热使体系温度升高外,可能还有其它原因,他们联想到教材上的科学探究实验,推断出反应混合溶液中的__________(填化学式)也加速了此反应的进行。
(3)上述实验①中充分反应后H2C2O4过量,假设理论上能通过用酸性KMnO4溶液滴定的方法来测定反应混合液中过量的H2C2O4,请回答下列问题:
①取用反应混合液的滴定管用__________滴定管(填“酸式”或“碱式”,下同),盛装KMnO4溶液的滴定管用__________滴定管。
②下列操作中可能使测出的H2C2O4剩余量比理论值偏低的是__________。
A.读取酸性KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放反应混合液的锥形瓶用蒸馏水洗净但没有干燥
C.盛装KMnO4溶液的滴定管滴定前有气泡,滴定后气泡消失
D.盛装KMnO4溶液的滴定管未润洗就直接注入酸性KMnO4溶液
③此滴定实验是否需要滴加指示剂________(填“是”或“否”);怎么确定此滴定的终点:_________。
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 | 初始 pH | 废水样品 体积/mL | 草酸溶液 体积/mL | 蒸馏水 体积/mL |
| ① | 4 | | 10 | 30 |
| ② | 5 | 60 | 10 | |
| ③ | | 60 | | 20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
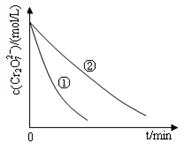
(2)实验①和②的结果表明_______________________________;
(3)该课题组队铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(4)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
常温下,下列离子能使纯水中的H+离子数目增加的是 ( )
| A.S2- | B.CO32- | C.NH4+ | D.Br- |

 N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。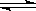 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。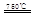 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg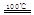 HgBr2+H2
HgBr2+H2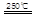 _____ + ④2HgO
_____ + ④2HgO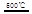 2Hg+O2↑
2Hg+O2↑ CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
 2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为