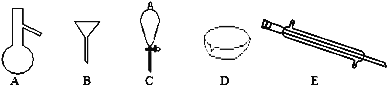题目内容
【题目】用规范的化学用语回答下列问题
(1)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

①从氯化钾溶液中得到氯化钾固体,选择装置__________ (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置_________,为检测Cl-杂质是否除干净,应进行的操作_________________________________
②从碘水中分离出I2的方法,名称为________________________。
③装置A中①的名称是________,进水的方向是从______(填“上”“下”)口进水,装置B在分液时为使液体顺利下滴,应进行的具体操作是_______________________。
(2)实验室配制Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,并继续加热至溶液呈红褐色,停止加热。向所得胶体中逐滴加入稀硫酸,开始观察到的现象是__________,这种现象称为胶体的________;最后观察到的现象是_________。
【答案】D A 取少量液体于试管中,加硝酸酸化的硝酸银溶液,若有白色沉淀生成,则有Cl- 萃取 冷凝管 下 打开分液漏斗上端玻璃塞或使玻璃塞上的凹槽对准漏斗上的小孔 有红褐色沉淀生成 聚沉 沉淀溶解
【解析】
(1)①蒸发可以实现易溶于水的固体和水的分离;分离沸点不同的混合物可以用蒸馏的方法;Cl-与Ag+反应生成氯化银白色沉淀,因此检测Cl-杂质是否除干净,应用硝酸酸化的硝酸银溶液,观察是否有白色沉淀生成;
②碘微溶于水,碘易溶于苯、四氯化碳等有机溶剂,且苯、四氯化碳与水互不相溶,可用萃取法分离;
③装置A为蒸馏装置,①为冷凝管,使用时下口进水上口出水可充分冷凝,装置B中在使用分液漏斗时,要打开分液漏斗上端玻璃塞或使玻璃塞上的凹槽对准漏斗上的小孔,以保证内部液体顺利流下;
(2)向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,即制得Fe(OH)3胶体,氢氧化铁胶体滴入硫酸先聚沉生成沉淀氢氧化铁,继续滴入硫酸,氢氧化铁沉淀溶解。
(1)①蒸发可以实现易溶于水的固体和水的分离,从氯化钾溶液中得到氯化钾固体可用蒸发的方法;因蒸馏可以实现水中难挥发性杂质和水的分离,则除去自来水中的Cl-等杂质,可用蒸馏的方法;检测Cl-杂质是否除干净,应进行的操作为取少量液体于试管中,加硝酸酸化的硝酸银溶液,若有白色沉淀生成,则有Cl-;
故答案为:取少量液体于试管中,加硝酸酸化的硝酸银溶液,若有白色沉淀生成,则有Cl-;
②碘微溶于水,碘易溶于苯、四氯化碳等有机溶剂,且苯、四氯化碳与水互不相溶,可用萃取法分离;
故答案为:萃取;
③装置A中①的名称是冷凝管,使用时下口进水上口出水,装置B中在使用分液漏斗时,要打开分液漏斗上端玻璃塞或使玻璃塞上的凹槽对准漏斗上的小孔,以保证内部液体顺利流下;
故答案为:冷凝管;下;打开分液漏斗上端玻璃塞或使玻璃塞上的凹槽对准漏斗上的小孔;
(2)向Fe(OH)3胶体中逐滴加入过量的稀硫酸,胶体在电解质溶液中阴阳离子作用下产生聚沉现象,有红褐色沉淀生成,继续滴入硫酸后氢氧化铁又和硫酸反应生成水和可溶性的硫酸铁,所以现象为:开始滴加时有红褐色沉淀出现,继续滴加沉淀溶解,
故答案为:有红褐色沉淀生成;聚沉;沉淀溶解。

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案