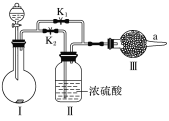
题目内容
【题目】根据所学知识,回答下列问题:
I. 0.5L 1mol·l-1 氢氧化钠溶液中所含溶质的质量为________g,加水将溶液稀释到10L,其物质的量浓度是_________mol·l-1,取稀释后的溶液 10mL,其溶质的物质的量浓度是________mol·L-1.
Ⅱ.标准状况下,比较等物质的量 H2S、NH3、CH4 三种气体,并完成下列填空。
(1)体积之比________
(2)质量之比为________
(3)原子数之比为________
(4)氢原子数之比为________
【答案】20 0.05 0.05 1:1:1 34:17:16 3:4:5 2:3:4
【解析】
I. m=cVM=1mol·l-1×0.5L×40g/mol=20g;
c2=![]() =
=![]() =0.05 mol·l-1;
=0.05 mol·l-1;
从10L的溶液中取出其中的10ml,溶液的溶度不发生变化,依然是0.05 mol·l-1;
Ⅱ.(1)根据阿伏伽德罗定律有体积之比等于物质的量之比,三种气体的物质的量相同,则体积之比为1:1:1;
(2)由m=nM,可知质量之比为摩尔质量之比,则三种气体的质量之比=34:17:16;
(3)H2S由3个原子构成,NH3由4个原子构成,CH4 由5个原子构成,物质的量相同的三种气体原子数之比为3:4:5;
(4)H2S中含有2个氢原子, NH3中含有3个氢原子,CH4中含有4个氢原子,则三种气体的氢原子数之比为2:3:4。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】A、B、C、D, E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有6种不同运动状态的电子 |
C | 基态原子中s电子总数与p电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为3s23p1 |
F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第_______周期_______族;B元素和C元素的第一电离能比较,较大的是________,C元素和F元素的电负性比较,较小的是________。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子模型为________,B元素所形成的单质分子![]() 键与π键数目之比为________。
键与π键数目之比为________。
(3)G元素的低价阳离子的离子结构示意图是________,F元素原子的价电子的轨道表示式是________,H元素的基态原子核外电子排布式的________。
(4)G的高价阳离子的溶液与H单质反应的离子方程式为_________________;与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的离子方程式:_________________。