题目内容
18.取1L 5mol/L的盐酸与足量的锌反应制取氢气,反应开始到10s末时盐酸浓度变为3mol/L,计算:(1)这10s内盐酸的平均反应速率;
(2)生成的氢气的体积(标准状况).
分析 (1)根据v=$\frac{△c}{△t}$计算10s内盐酸的平均反应速率;
(2)根据HCl浓度变化量计算参加反应HCl物质的量,再根据H原子守恒计算生成氢气物质的量,根据V=nVm计算氢气体积.
解答 解:(1)10s内盐酸的平均反应速率为$\frac{5mol/L-3mol/L}{10s}$=0.2mol/(L.s),
答:10s内盐酸的平均反应速率为0.2mol/(L.s);
(2)参加反应HCl物质的量为1L×(5mol/L-3mol/L)=2mol,根据H原子守恒,生成氢气物质的量为$\frac{2mol}{2}$=1mol,故标况下生成氢气体积为1mol×22.4L/mol=22.4L,
答:标况下生成氢气为22.4L.
点评 本题考查化学反应速率计算、化学方程式计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
8.下列物质与常用危险化学品的类别不对应的是( )
| A. | CH4、C2H4--易燃液体 | B. | H2SO4、NaOH--腐蚀品 | ||
| C. | CaC2、Na--遇湿易燃物品 | D. | KMnO4、K2Cr2O7--氧化剂 |
6.下列有关“电离平衡”的叙述中正确的是( )
| A. | 电解质在溶液里达到电离平衡时,溶质电离出的离子浓度相等 | |
| B. | 电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡 | |
| C. | 电离平衡时,弱电解质分子电离成离子的速率为零 | |
| D. | 电解质达到电离平衡后,各种离子的浓度不再变化 |
13.下列化学用语的书写正确的是( )
| A. | 氯分子的电子式 Cl:Cl | B. | 氢分子的电子式 H:H | ||
| C. | 氯化镁的电子式 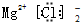 | D. | 氯化钠的电子式 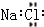 |
3.下列除去杂质的操作方法正确的是( )
| A. | 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 | |
| B. | 氯化铵中少量的碘:加热 | |
| C. | CO2中混有少量的HCl:通过饱和的NaHCO3溶液后再干燥 | |
| D. | N2中混有少量的NO2:通过水洗涤 |
7.下列说法不正确的是( )
| A. | HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关 | |
| B. | H2O的熔、沸点高于H2S是由于H2O分子之间存在氢键 | |
| C. | 甲烷可与水形成氢键 | |
| D. | I2易溶于CCl4可以用相似相溶原理解释 |
8.下列离子方程式书写不正确的是( )
| A. | NaOH和稀H2SO4:OH-+H+═H2O | |
| B. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | 碳酸钠溶液中通入少量CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | NaHCO3和H2SO4反应:HCO3-+H+═H2O+CO2↑ |

 出发合成A,其合成路线如下:已知:A在酸性条件下水解生成有机物B和甲醇.
出发合成A,其合成路线如下:已知:A在酸性条件下水解生成有机物B和甲醇.
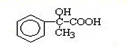 .
.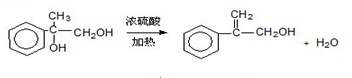 .
.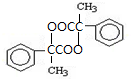 .
.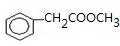 .
.