题目内容
10.1.92g铜和一定量的浓HNO3反应,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当铜反应完毕时,共收集到气体1.12L(标准状况).求:(1)反应消耗的HNO3的物质的量.
(2)反应生成的气体水洗后剩余多少体积?
分析 n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,收集的气体是氮氧化物,n(NOx)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
(1)该反应中硝酸有两个作用,一个起酸作用,一个作氧化剂,根据N原子守恒得消耗n(HNO3)=2n[Cu(NO3)2]+n(NOx);
(2)将混合气体水洗后,发生反应3NO2+H2O=2HNO3+NO,硝酸转化为NO2、NO2转化为硝酸时,N元素化合价不变,NO和水不反应,所以整个过程中根据转移电子相等知,Cu失去电子数等于最终得到NO转移电子数,据此分析解答.
解答 解:n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,收集的气体是氮氧化物,n(NOx)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
(1)该反应中硝酸有两个作用,一个起酸作用,一个作氧化剂,根据N原子守恒得消耗n(HNO3)=2n[Cu(NO3)2]+n(NOx)=2×0.03mol+0.05mol=0.11mol,
答:反应消耗的HNO3的物质的量是0.11mol;
(2)将混合气体水洗后,发生反应3NO2+H2O=2HNO3+NO,硝酸转化为NO2、NO2转化为硝酸时,N元素化合价不变,NO和水不反应,所以整个过程中根据转移电子相等知,Cu失去电子数等于最终得到NO转移电子数,设生成最终得到NO物质的量为xmol,(5-2)xmol=0.03mol×2,x=0.02mol,则V(NO)=0.02mol×22.4L/mol=0.448L,
答:反应生成的气体水洗后剩余体积为0.448 L.
点评 本题考查氧化还原反应的有关计算,侧重考查学生分析计算能力,正确分析反应过程是解本题关键,利用原子守恒、转移电子守恒解答即可,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 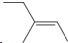 :3-甲基-2-戊烯 :3-甲基-2-戊烯 | B. |  :2-甲基-3-丁炔 :2-甲基-3-丁炔 | C. | 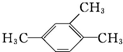 :1,3,4-三甲苯 :1,3,4-三甲苯 | D. |  :2-甲基-1-丙醇 :2-甲基-1-丙醇 |
| A. | C2H4 | B. | HClO | C. | NH3 | D. | H2O2 |
(1)C的生成速率与C的分解速率相等;(2)单位时间生成amol A,同时生成3amol B;(3)A、B、C的浓度不再变化;(4)混合气体的总压强不再变化;(5)速率V(A):V(B):V(C)=1:3:2;(6)条件一定,混和气体的平均相对分子质量不再变化;(7)A、B、C的分子数目比为1:3:2.
| A. | (1)(2)(4)(7) | B. | (2)(3)(5)(6) | C. | (1)(3)(4)(6) | D. | (1)(3)(5)(7) |
| A. | 1 mol/L Na2CO3溶液中的Na+ 数目为2NA | |
| B. | 7.8 g Na2O2所含离子总数为0.4 NA | |
| C. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 | |
| D. | 34 g OH-中含质子数20NA |
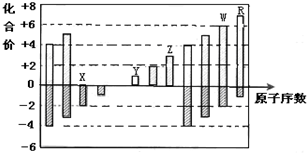
| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R>W | |
| C. | 最高价氧化物的水化物的碱性:Y<Z | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |