题目内容
7.下列说法不正确的是( )| A. | HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关 | |
| B. | H2O的熔、沸点高于H2S是由于H2O分子之间存在氢键 | |
| C. | 甲烷可与水形成氢键 | |
| D. | I2易溶于CCl4可以用相似相溶原理解释 |
分析 A、HCl、HBr、HI都是分子晶体,所以熔、沸点依次升高与分子间作用力有关;
B、氢键是比范德华力大的一种分子间作用力;
C、与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力为氢键;
D、极性分子易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂.
解答 解:A、HCl、HBr、HI都是分子晶体,所以熔、沸点依次升高与分子间作用力有关,故A正确;
B、氢键是比范德华力大的一种分子间作用力,水分子间可以形成氢键,H2S分子间不能形成氢键,因此H2O的熔、沸点高于H2S,故B正确;
C、甲烷中C原子电负性不大,所以甲烷分子和水分子之间不能形成氢键,故C错误;
D、碘是非极性分子易溶于非极性溶剂四氯化碳,甲烷属于非极性分子难溶于极性溶剂水,所以都可用相似相溶原理解释,故D正确.
故选:C.
点评 本题考查氢键对物质性质的影响以及不同晶体中影响物质熔沸点的因素,综合性较强,首先判断属于何种晶体,然后再根据同种晶体中粒子作用力的差异进行判断.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
17.将 转变为
转变为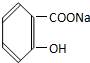 ,下列操作正确的是( )
,下列操作正确的是( )
 转变为
转变为 ,下列操作正确的是( )
,下列操作正确的是( )| A. | 与氢氧化钠共热后通足量的二氧化碳 | |
| B. | 溶解,加热通足量的二氧化硫气体 | |
| C. | 与稀硫酸共热后加足量氢氧化钠 | |
| D. | 与稀硫酸共热后加足量碳酸钠 |
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol/L Na2CO3溶液中的Na+ 数目为2NA | |
| B. | 7.8 g Na2O2所含离子总数为0.4 NA | |
| C. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 | |
| D. | 34 g OH-中含质子数20NA |
16.将10mL 0.2mol/L CuSO4溶液与20mL 0.15mol/L Ba(OH)2溶液混合,反应后,溶液中离子浓度最大的是( )
| A. | OH- | B. | SO${\;}_{4}^{2-}$ | C. | Ba2+ | D. | Cu2+ |
1.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 硅酸胶体:OH-、K+、S2-、Na+ | B. | 空气:C2H4、CO、SO2、NO | ||
| C. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | D. | 高锰酸钾溶液:H+、Na+、SO42-、Fe2+ |
 ,B元素名称为钾;
,B元素名称为钾;