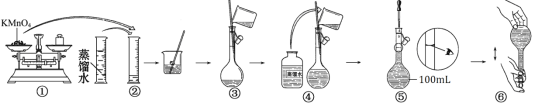
题目内容
【题目】硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂、媒染剂。实验室拟用废旧印刷电路板(含有Cu、Fe、Al、Zn)制备该晶体,具体流程如下:

已知:硫酸四氨合铜易溶于水,不溶于乙醇、四氯化碳等有机溶剂;常温下,硫酸四氨合铜在空气中易与水和二氧化碳反应,受热时易失氨。
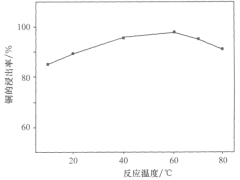
(1)某科研小组选取一定量的稀硝酸和稀硫酸的混合酸溶解废旧印刷电路板时,得出温度与铜的浸出率关系如图所示。步骤①中采用合适的加热方式是___;温度越高,铜的浸出率反而下降,原因可能是___。
(2)步骤②、③需要的玻璃仪器有___;检验“水相Ⅱ”中是否含有Fe3+所需试剂为___。
(3)步骤④中氨水必须适当过量的原因是___。
(4)步骤⑥的具体操作为___。
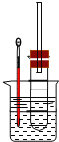
(5)样品中NH3含量测定:实验装置如图所示,称取0.3400g样品放入圆底烧瓶中,加入80mL水溶解,再加入10%NaOH溶液10.00mL。在锥形瓶中,准确加入0.5000mol·L-lHC1标准溶液36.00mL,放入冰水浴中冷却。先大火后小火加热烧瓶,并保持微沸1h左右。取出插入HC1溶液中的导管,从冰水浴中取出锥形瓶,滴加2滴0.1%甲基红溶液,用0.5000mol·L-1NaOH标准溶液滴定剩余溶液,消耗NaOH标准溶液28.00mL。

样品中NH3的质量分数为___(保留两位有效数字),实验检测结果比理论值偏小的原因可能是___(写一种可能原因)。
【答案】约60℃热水浴 温度高,硝酸挥发,因硝酸量一定,造成铜的浸出率下降(或温度高,硝酸氧化性增强,硝酸反应后生成了NO2,增加了硝酸的消耗量,铜的浸出率降低) 分液漏斗、烧杯 KSCN溶液 使Cu2+充分反应,提高铜的转化率 向过滤器中加入乙醇至浸没沉淀,待洗涤液完全流出后,重复上述操作2到3次 20% 装置中残留一部分氨;样品在干燥时温度偏高,部分氨已失去
【解析】
废旧印刷电路板(含有Cu、Fe、Al、Zn)在加热的条件下酸溶金属转化为阳离子,由于最终制备的是硫酸四氨合铜晶体,所以溶液中的金属阳离子除铜离子被萃取到水相中,然后将有机相中的铜离子在被反萃取到水相Ⅱ中,然后加入氨水得到硫酸四氨合铜,据此解答。
(1)结合图像一我们发现浸出率最高的温度是60℃,在这个温度下用热水浴是最合适的加热方法;因为我们选用的是硝酸和硫酸进行浸出,硫酸是难挥发的,但是硝酸受热易挥发,因此当温度过高时硝酸部分挥发,导致浸出率反而下降;也可根据不同温度下硝酸的还原产物不同来作答,即答案为温度升高硝酸的氧化性增强,还原产物变为![]() ,每个硝酸能得的电子减少了,需要的硝酸就会变多,浸出率自然会下降;
,每个硝酸能得的电子减少了,需要的硝酸就会变多,浸出率自然会下降;
(2)步骤二既然是反萃取(萃取的一种)、分液,需要的玻璃仪器为分液漏斗和烧杯;而检验![]() 的最佳试剂为
的最佳试剂为![]() 溶液;
溶液;
(3)步骤④是为了将步骤③得到的硫酸铜转变为硫酸四氨合铜产物,因此这一步加入过量的氨水可以有效地将![]() 转变为产物,提高转化率;
转变为产物,提高转化率;
(4)步骤⑥为洗涤,目的是为了洗去产品中可能残留的有机或无机杂质,根据题目所给的信息硫酸四氨合铜不溶于乙醇、四氯化碳等有机溶剂,因此我们可以用有机溶剂来洗涤,具体操作为向过滤器中加入乙醇至浸没沉淀;待洗涤液完全流出后,重复上述操作2至3次;
(5)根据描述和装置图我们要测量样品中的![]() 含量,先通过加碱和加热将样品中的
含量,先通过加碱和加热将样品中的![]() 全部“赶”到锥形瓶中与
全部“赶”到锥形瓶中与![]() 反应,中和掉一部分酸,再用标准
反应,中和掉一部分酸,再用标准![]() 溶液去滴定剩余的酸。首先根据
溶液去滴定剩余的酸。首先根据![]() 算出
算出![]() 原来的量,再根据
原来的量,再根据![]() 算出消耗的
算出消耗的![]() 的量,因此
的量,因此![]() 中和了0.004mol的
中和了0.004mol的![]() ,又因为
,又因为![]() 和
和![]() 是1:1中和的,所以样品中有
是1:1中和的,所以样品中有![]() 共0.004mol,由
共0.004mol,由![]() 算出
算出![]() 的质量,最后算出其质量分数
的质量,最后算出其质量分数![]() ;若实测结果比理论小,可能是部分氨气未进入锥形瓶中或样品在干燥时温度偏高,部分氨已失去。
;若实测结果比理论小,可能是部分氨气未进入锥形瓶中或样品在干燥时温度偏高,部分氨已失去。

【题目】如图为元素周期表的一部分,已知D为金属元素且其原子核外内层电子数为最外层电子数的5倍
A | B | C | ||||
D | E | X | ||||
G | ||||||
Y |
请回答下列问题:
(1)元素B在元素周期表中的位置为________
(2)元素A和元素E的最简单氢化物中沸点较高的是_____(填化学式)
(3)已知BC2中所有原子的最外层均满足8电子稳定结构,则BC2的电子式为_____其中B元素的化合价为______价。
(4)D3A2与H2O反应可生成两种碱,请写出该反应的化学方程式____________
(5)Y与X的原子序数之差为____________.