题目内容
【题目】将0.1mol/L CH3COOH溶液加入水稀释或加入少量CH3COONa晶体时,都会引起
A. 溶液中pH增大B. CH3COOH的电离程度变大
C. 溶液的导电能力减弱D. CH3COO-的浓度变小
【答案】A
【解析】
CH3COOH溶液中存在电离平衡CH3COOH![]() CH3COO-+ H+,加水稀释,平衡向正反应方向移动;加入少量CH3COONa晶体时,平衡向逆反应方向移动,据此分析解答。
CH3COO-+ H+,加水稀释,平衡向正反应方向移动;加入少量CH3COONa晶体时,平衡向逆反应方向移动,据此分析解答。
A.CH3COOH溶液加水稀释,平衡向正反应方向移动,溶液的pH增大,CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,c(H+)减小,溶液的pH增大,故A正确;
B.CH3COOH溶液加水稀释,平衡向正反应方向移动,醋酸的电离程度增大;加入少量CH3COONa晶体,平衡向逆反应方向移动,醋酸的电离程度减小,故B错误;
C.CH3COOH溶液加水稀释,离子浓度减小,溶液的导电能力减弱;加入少量CH3COONa晶体,离子浓度增大,溶液的导电能力增强,故C错误;
D.CH3COOH溶液加水稀释,平衡向正反应方向移动,促进醋酸电离,但溶液中CH3COO-浓度减小;加入少量CH3COONa晶体,CH3COO-浓度增大,平衡向逆反应方向移动,电离程度减小,故D错误;
答案选A。

【题目】(1)现用氯化铜晶体(CuCl2·2H2O,含少量FeCl2杂质)制取纯净的CuCl2·2H2O,先将其制成水溶液,后按如图步骤进行提纯:

已知:相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
Ksp | 2.0×10ˉ20 | 1.0×10ˉ38 | 1.64×10ˉ14 |
请回答下列问题:
①请从下列物质中选出第一步中需加入的X(__________)
a.NaClO b.H2O2 c.KMnO4 d.HNO3
②溶液Ⅱ中含有少量的Fe3+,如何检验该离子的存在:_____________________________。
③若此时溶液中的c(Cu2+)=0.02mol/L,为得到纯净的CuCl2·2H2O晶体,可加入CuO固体,使溶液中的Fe3+完全转化为Fe(OH)3沉淀且不沉淀Cu2+,调节pH的范围是_______。(通常认为残留在溶液中的离子浓度小于或等于1×10ˉ5 mol/L时就认为沉淀完全)。
④由溶液Ⅲ得到CuCl2·2H2O晶体的操作是___________________________________。
(2)镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiO(OH)+H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
回答下列问题:
①放电时,金属Cd作_______极;
②充电时的阳极电极反应式为_____________________________________________。
③充电时,当电路中通过0.2moleˉ,阴极质量将_______(填“增加”、“减少”)___g。
【题目】Ⅰ.利用测压法在刚性反应器中研究 T℃ 时:
3NO2(g)![]() 3NO(g)+O3(g) ΔH=+317.3kJ·mol-1的分解反应,体系的总压强 p随时间 t 的变化如下表所示:
3NO(g)+O3(g) ΔH=+317.3kJ·mol-1的分解反应,体系的总压强 p随时间 t 的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
(1)该反应达到平衡后的熵值较平衡前______________(填“增大”“减小”“不变”)。
(2)若降低反应温度,则平衡后体系压强 p____24.00 MPa(填“大于”“等于”“小于”),原因是_____________________________________________________________________。15min 时,反应物的转化率 α=__________%
Ⅱ.一定条件下,在体积为 2 L 的密闭容器中发生反应:2NO2(g)![]() 2NO(g)+O2(g) ΔH>0。投入 2 mol NO2发生反应。实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为 T℃ 时 NO2 的转化率随时间变化的结果如图所示。
2NO(g)+O2(g) ΔH>0。投入 2 mol NO2发生反应。实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为 T℃ 时 NO2 的转化率随时间变化的结果如图所示。
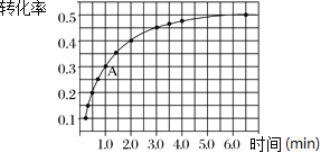
(1)要提高 NO2转化率,可采取的措施是________________ 、__________________。
(2)前2min内,以NO2表示该反应的化学反应速率为___________________。
(3)计算 A 点处v正/ v逆=_________________(保留一位小数)。


