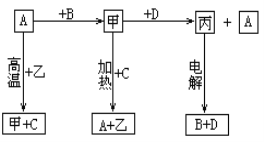
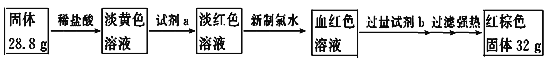
题目内容
【题目】溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
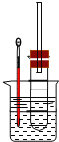
实验操作I:在试管中加入5mL 1mol/L NaOH水溶液和5mL溴乙烷,将试管按如图固定后,加热。
(1)请写出该反应的化学方程式_______。
(2)观察到_____现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)欲将生成的有机物从反应混合物中进行分离出来,最简单的操作是____(填操作名称)。
(4)请述如何检验溴乙烷中含有溴元素___________
实验操作Ⅱ:在试管中加入5 mL NaOH的乙醇溶液和5mL溴乙烷,将试管如图固定后,加热。
(5)请写出该反应的化学方程式_______。
(6)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是_______(写化学式),检验的方法是_________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)
【答案】CH3CH2Br + NaOH![]() CH3CH2OH + NaBr 混合物不分层 蒸馏 取试管中的溶液少许于另一支试管中,加入稀硝酸酸化,然后加入AgNO3溶液有浅黄色沉淀生成,说明溴乙烷中含有溴元素 CH3CH2Br + NaOH
CH3CH2OH + NaBr 混合物不分层 蒸馏 取试管中的溶液少许于另一支试管中,加入稀硝酸酸化,然后加入AgNO3溶液有浅黄色沉淀生成,说明溴乙烷中含有溴元素 CH3CH2Br + NaOH![]() CH2=CH2 ↑ + NaBr + H2O CH2=CH2 将生成的气体通入溴水,溴水褪色
CH2=CH2 ↑ + NaBr + H2O CH2=CH2 将生成的气体通入溴水,溴水褪色
【解析】
溴乙烷与氢氧化钠水溶液发生取代反应,与氢氧化钠的醇溶液发生消去反应。
(1)溴乙烷在氢氧化钠的水溶液中发生取代反应生成乙醇和溴化钠,化学方程式为
CH3CH2Br + NaOH![]() CH3CH2OH + NaBr。
CH3CH2OH + NaBr。
(2)生成的产物乙醇与水互溶,所以混合物不出现分层现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)乙醇的沸点低,所以将乙醇从溶液中分离出来只能采用蒸馏的方法。
(4)检验溴乙烷中含有溴元素,需要硝酸银溶液,再加入硝酸银溶液前先加酸使溶液呈酸性,具体操作是取试管中的溶液少许于另一支试管中,加入稀硝酸酸化,然后加入AgNO3溶液有浅黄色沉淀生成,说明溴乙烷中含有溴元素。
(5)溴乙烷在氢氧化钠的醇溶液中发生消去反应生成乙烯和溴化钠、水,化学方程式为
CH3CH2Br + NaOH![]() CH2=CH2 ↑ + NaBr + H2O。
CH2=CH2 ↑ + NaBr + H2O。
(6)无论溴乙烷发生取代还是消去反应共同产物是溴化钠,所以证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,只能检验产物乙烯;检验的方法是将生成的气体通入稀溴水,溴水褪色;或通入酸性高锰酸钾溶液,紫色褪去。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案