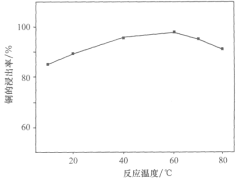
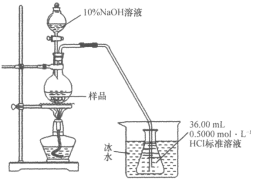
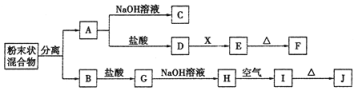
题目内容
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.加铁氰化钾产生蓝色沉淀的溶液中:Na+、Al3+、SO42-、ClO-
B.0.1mol/L的烧碱溶液中:K+、Ba2+、Cl-、HCO3-
C.![]() =1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
D.水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
【答案】C
【解析】
A. 加铁氰化钾产生蓝色沉淀的溶液中含有Fe2+,Fe2+与ClO-不能大量共存,与题意不符,A错误;
B. 0.1mol/L的烧碱溶液中含有大量的OH-,OH-与HCO3-不能大量共存,与题意不符,B错误;
C. ![]() =1×10-13 mol·L-1的溶液中含有大量的H+,H+与NH4+、Ca2+、Cl-、NO3-能大量共存,符合题意,C正确;
=1×10-13 mol·L-1的溶液中含有大量的H+,H+与NH4+、Ca2+、Cl-、NO3-能大量共存,符合题意,C正确;
D. 水电离的c(H+)=1×10-13 mol·L-1的溶液中含有大量的OH-或H+,H+与AlO2-、CO32-不能大量共存,与题意不符,D错误;
答案为C。

练习册系列答案
相关题目