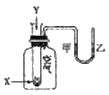
题目内容
【题目】如图为元素周期表的一部分,已知D为金属元素且其原子核外内层电子数为最外层电子数的5倍
A | B | C | ||||
D | E | X | ||||
G | ||||||
Y |
请回答下列问题:
(1)元素B在元素周期表中的位置为________
(2)元素A和元素E的最简单氢化物中沸点较高的是_____(填化学式)
(3)已知BC2中所有原子的最外层均满足8电子稳定结构,则BC2的电子式为_____其中B元素的化合价为______价。
(4)D3A2与H2O反应可生成两种碱,请写出该反应的化学方程式____________
(5)Y与X的原子序数之差为____________.
【答案】第二周期第VIA族 NH3 ![]() +2 Mg3N2+8H2O=3Mg(OH)2↓+2NH3·H2O 36
+2 Mg3N2+8H2O=3Mg(OH)2↓+2NH3·H2O 36
【解析】
D为金属元素且其原子核外内层电子数为最外层电子数的5倍,则D为Mg,根据元素在周期表中的位置可知:A为N;B为O;C为F;E为P;X为Ar;G为Kr;Y为Xe,据此分析解答。
(1)元素B为O,处于第二周期VIA族,故答案为:第二周期第VIA族;
(2)元素A和元素E的最简单氢化物分别为PH3和NH3,因氨气分子间存在氢键导致其沸点较高,故答案为:NH3;
(3) BC2为OF2,电子式为:![]() ,因F的非金属性比O强,在该化合物中F为-1价,O为+2价,故答案为:
,因F的非金属性比O强,在该化合物中F为-1价,O为+2价,故答案为:![]() ;+2;
;+2;
(4)D3A2为Mg3N2与H2O反应可生成两种碱分别为氢氧化镁和一水合氨,反应为:Mg3N2+8H2O=3Mg(OH)2↓+2NH3·H2O,故答案为:Mg3N2+8H2O=3Mg(OH)2↓+2NH3·H2O;
(5) X为Ar,原子序数为18;Y为Xe,原子序数为54,两者原子序数差为36,故答案为:36;

【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的 NO,进行反应C(s)+2NO(g) ![]() N2(g)+CO2(g),测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
N2(g)+CO2(g),测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
容器(温度) | 0min | 40min | 80min | 120min | 160min | |
甲(400℃) | c(NO) | 2.00 mol/ L | 1.50 mol/ L | 1.10 mol/ L | 0.80 mol/ L | 0.80 mol/ L |
乙(400℃) | c(NO) | 1.00 mol/ L | 0.80 mol/ L | 0.65 mol/ L | 0.53 mol/ L | 0.45 mol/ L |
丙(T℃) | c(NO) | 2.00 mol/ L | 1.40 mol/ L | 1.10 mol/ L | 1.10 mol/ L | 1.10 mol/ L |
A.达到平衡状态时,2v正(NO)= v逆(N2)
B.活性炭的质量不再改变不能说明反应已达平衡状态
C.丙容器中,从反应开始到建立平衡时的平均反应速率为v(NO) >0.01125 mol·L-1·min-1
D.由表格数据可知:T<400℃