题目内容
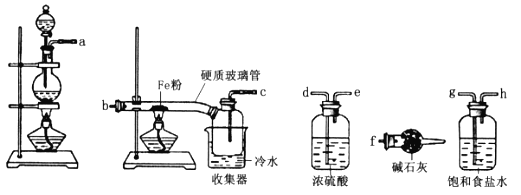
【题目】氯化亚铜(CuCl)是一种重要的化工原料,常用作催化剂、杀菌剂。化学小组用如图装置(部分夹持装置略去)制备氯化亚铜。
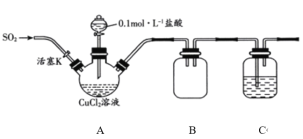
已知:①氯化亚铜是一种白色固体,能溶于氨水,微溶于水,不溶于酒精;在空气中会被迅速氧化。
②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
实验步骤:
I.打开分液漏斗活塞,向三颈瓶中加盐酸调pH至2~3。打开活塞K,通入SO2,溶液中产生白色沉淀,待反应完全后,再通一段时间的气体。
II.将反应混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)装置B的作用是________。
(2)步骤I中通入SO2发生反应的离子方程式是________。
(3)步骤II中采用抽滤法过滤的主要目的是________;用95%的乙醇代替蒸馏水洗涤的优点是________。
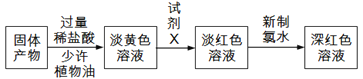
(4)化学小组同学在实验过程中,将分液漏斗中的0.lmolL-1盐酸换为6molL-1盐酸,通入SO2,最终未得到白色沉淀。
①对此现象有如下猜想:
猜想一:Cl-浓度过大,与CuCl发生反应
小组同学对猜想一的原理进行深入研究,查阅资料知:CuCl+Cl-CuCl2-,据此设计实验:将上述未得到沉淀的溶液_____(填操作),若观察到有白色沉淀析出,证明猜想一正确。
②猜想二:________。
设计验证猜想二是否成立的实验方案________。
【答案】安全瓶或防止发生倒吸 SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+ 快速过滤,防止氯化亚铜被氧化 减小CuCl的损失,同时加快固体的干燥 加水稀释 强酸性条件下,CuCl发生自身氧化还原反应(歧化反应) 取CuCl固体,加入3rnolL-1的H2SO4溶液,若白色沉淀消失,得到蓝色溶液,有红色固体生成,证明猜想二成立,反之,不成立
【解析】
(1)B装置可防止尾气处理时产生倒吸;
(2)SO2与氯化铜溶液反应生成氯化亚铜和硫酸;
(3)步骤II中采用抽滤法可加快过滤的速度,减少有空气接触的时间;已知①氯化亚铜是一种白色固体,能溶于氨水,微溶于水,不溶于酒精;在空气中会被迅速氧化分析;
(4)①Cl-浓度过大,与CuCl发生反应,减小Cl-浓度的浓度观察是否有沉淀生成;
②根据已知信息②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
(1)SO2属于大气污染物,不能排放到空气中,用NaOH溶液处理尾气时容易引起倒吸,B装置可防止尾气处理时产生倒吸,B装置的作用为安全瓶或防止发生倒吸;
(2)SO2与氯化铜溶液反应生成氯化亚铜和硫酸,离子反应方程式为:SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(3)已知①氯化亚铜是一种白色固体,能溶于氨水,微溶于水,不溶于酒精;在空气中会被迅速氧化,步骤II中采用抽滤法可加快过滤的速度,减少有空气接触的时间,防止氯化亚铜被氧化;氯化亚铜微溶于水,不溶于酒精,且酒精具有挥发性,可快速带走固体表面的水分,则用95%的乙醇代替蒸馏水洗涤的优点是减小CuCl的损失,同时加快固体的干燥;
(4)①Cl-浓度过大,与CuCl发生反应,减小Cl-的浓度观察是否有沉淀生成,则操作为将上述未得到沉淀的溶液加水稀释,若观察到有白色沉淀析出,说明猜想一Cl-浓度过大影响氯化亚铜的生成是正确的;
②根据已知信息②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应,则猜想二为强酸性条件下,CuCl发生自身氧化还原反应(歧化反应),验证猜想的方法为:取CuCl固体,加入3rnolL-1的H2SO4溶液,若白色沉淀消失,得到蓝色溶液,有红色固体生成,证明猜想二成立,反之,不成立。

【题目】从接触法制硫酸的废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | VOSO4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
一种废钒催化剂回收工艺路线流程如下:
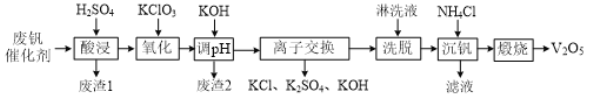
回答下列问题:
(1)“酸浸”时为了提高钒元素的浸出率,可以采取的措施是______。
(2)“酸浸”时可以得到![]() 和VO2+,“氧化”时VO2+转化为
和VO2+,“氧化”时VO2+转化为![]() 的离子方程式为______。
的离子方程式为______。
(3)“调pH”后钒以![]() 形式存在于溶液中。“废渣2”所含成分的化学式为____。
形式存在于溶液中。“废渣2”所含成分的化学式为____。
(4)“离子交换”和“洗脱”的过程可表示为:4ROH+![]()
![]() R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
(5)“沉钒”时得到偏钒酸铵(NH4VO3)沉淀。
①检验偏钒酸铵沉淀是否洗涤干净的方法是______。
②“煅烧”中发生反应的化学方程式为______。
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
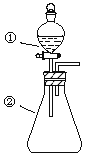
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 新制氯水 | 淀粉碘化钾溶液 | 溶液变蓝色 |
D | 浓盐酸 | MnO2 | 产生黄绿色气体 |
A.AB.BC.CD.D