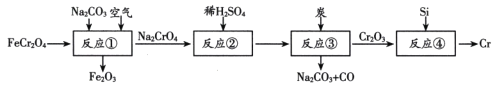
题目内容
【题目】从接触法制硫酸的废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | VOSO4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
一种废钒催化剂回收工艺路线流程如下:
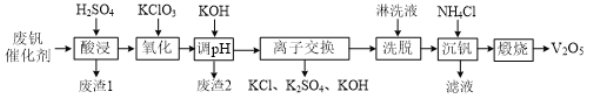
回答下列问题:
(1)“酸浸”时为了提高钒元素的浸出率,可以采取的措施是______。
(2)“酸浸”时可以得到![]() 和VO2+,“氧化”时VO2+转化为
和VO2+,“氧化”时VO2+转化为![]() 的离子方程式为______。
的离子方程式为______。
(3)“调pH”后钒以![]() 形式存在于溶液中。“废渣2”所含成分的化学式为____。
形式存在于溶液中。“废渣2”所含成分的化学式为____。
(4)“离子交换”和“洗脱”的过程可表示为:4ROH+![]()
![]() R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
(5)“沉钒”时得到偏钒酸铵(NH4VO3)沉淀。
①检验偏钒酸铵沉淀是否洗涤干净的方法是______。
②“煅烧”中发生反应的化学方程式为______。
【答案】升高温度(或适当增大硫酸的浓度、将废钒催化剂进一步粉碎等合理答案) 6VO2++![]() +3H2O6
+3H2O6![]() +Cl+6H+ Fe(OH)3、Al(OH)3 将钒元素富集,除去杂质离子 取最后一次洗涤滤液,加入硝酸酸化的硝酸银,若无现象则证明沉淀已经洗涤干净 2NH4VO3
+Cl+6H+ Fe(OH)3、Al(OH)3 将钒元素富集,除去杂质离子 取最后一次洗涤滤液,加入硝酸酸化的硝酸银,若无现象则证明沉淀已经洗涤干净 2NH4VO3![]() V2O5+H2O↑+2NH3↑
V2O5+H2O↑+2NH3↑
【解析】
(1)提高固体的浸出率方法有升高温度、适当增大硫酸的浓度或者将废钒催化剂进一步粉碎等。
(2)氧化时反应物为VO2+和![]() ,生成物为
,生成物为![]() 和Cl,配平得相应的离子方程式为6VO2++
和Cl,配平得相应的离子方程式为6VO2++![]() +3H2O6
+3H2O6![]() +Cl+6H+。
+Cl+6H+。
(3)酸浸时,氧化铁、氧化铝均转化为金属阳离子,只有SiO2不溶,则过滤得到的滤渣1为SiO2,然后加氧化剂KClO3,将VO2+变为![]() ,再加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀。
,再加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀。
(4)根据流程图可知离子交换产生了KOH、KCl、K2SO4,排除了杂质离子,将钒元素富集。
(5)①检验方法是取最后一次洗涤滤液,加入硝酸酸化的硝酸银,若无现象则证明沉淀已经洗涤干净;
②加入NH4Cl产生了NH4VO3沉淀,NH4VO3分解产生了V2O5和H2O及NH3,化学方程式为2NH4VO3![]() V2O5+H2O↑+2NH3↑。
V2O5+H2O↑+2NH3↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.lmol1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g)![]() CH2=CHCH=CH2(g)+H2(g)△H。
CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)已知化学键键能数据如下,由此计算△H=____________kJmo1-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJmol-1 | 348 | 612 | 412 | 436 |
(2)如图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度600℃。
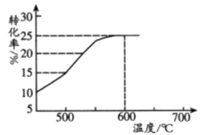
①请解释工业生产控制温度在600℃的原因___________。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=_________kPah-1;脱氢反应的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,p分=p总×物质的量分数)。
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol1,3-丁二烯,化学反应向_________(填“正反应”、“逆反应或“不移动”)方向进行 。