题目内容
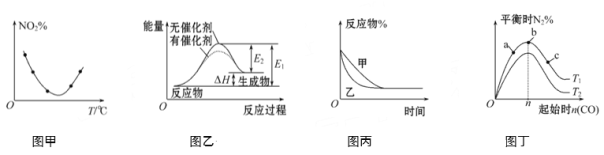
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
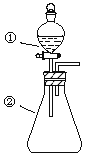
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 新制氯水 | 淀粉碘化钾溶液 | 溶液变蓝色 |
D | 浓盐酸 | MnO2 | 产生黄绿色气体 |
A.AB.BC.CD.D
【答案】C
【解析】
A.盐酸先与NaOH的反应,然后再与碳酸钠反应生成碳酸氢钠,最后盐酸与碳酸氢钠反应生成气体,则现象不合理,A错误;
B.常温下,Al遇浓硝酸发生钝化,不能观察到红棕色气体,B错误;
C.新制氯水具有强氧化性,与碘化钾反应生成单质碘,碘遇淀粉显蓝色,C正确;
D.浓盐酸与二氧化锰反应需要加热才能发生反应产生氯气,D错误;
答案选C。

【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g) +Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
D.该温度下此反应的平衡常数K=1.44
【题目】用50mL0.50mol/L 盐酸与50 mL0.55mol/LNaOH溶液,在右图装置中进行中和热的测定,请回答下列问题:
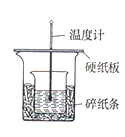
(1)从实验装置看,图中尚缺少的一种玻璃用品是________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是________。
(3)做1次完整的中和热测定实验,温度计需使用________次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?________。
(4)某同学实验记录数据如下表所示假设盐酸和氢氧化钠溶液的密度都是1g/mL,又知中和反应后生成溶液的比热容c=4.18J/(g.℃)根据该同学的实验数据计算,该实验测的中和热△H=________。
温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | |||
HCl | NaOH | ||||
1 | 20.0 | 20.1 | 23.2 | ||
2 | 20.2 | 20.4 | 23.4 | ||
3 | 20.5 | 20.6 | 23.6 | ||