题目内容
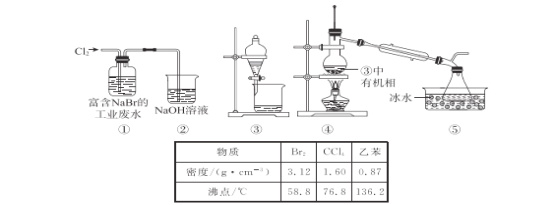
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
【答案】分液漏斗 防倒吸 浓盐酸 KMnO4 Na2S溶液 有淡黄色沉淀生成 Cl2+S2-=S↓+2Cl- 稀硫酸 Na2SiO3溶液
【解析】
(1)根据仪器的构造写出仪器A的名称;球形干燥管具有防止倒吸的作用;
(2)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证;
(3)要证明非金属性:S>C>Si,可以通过硫酸与碳酸钠反应产生二氧化碳,二氧化碳和硅酸钠反应生成难溶性的硅酸来证明。
(1)根据仪器结构可知仪器A的名称为分液漏斗,球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中;
(2)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证,则装置A、B、C中所装药品应分别为浓盐酸、KMnO4、Na2S溶液,装置C中的实验现象为有淡黄色沉淀生成,装置C中发生反应的离子方程式为Cl2+S2-=S↓+2Cl-;
(3)若要证明非金属性:S>C>Si,可以根据复分解反应的规律:强酸与弱酸的盐发生复分解反应制取弱酸。元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强。在装置A中放入稀硫酸,在装置B中放入Na2CO3,将稀硫酸滴入碳酸钠中,发生反应:H2SO4+Na2CO3=Na2SO4+CO2↑+H2O,硫酸不具有挥发性,将反应产生的CO2气体通入到盛有硅酸钠溶液的C装置中,在C中发生反应:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3,可观察到有白色胶状沉淀产生,产生了难溶性的硅酸沉淀,证明酸性:H2SO4>H2CO3>H2SiO3,进而证明了元素的非金属性S>C>Si。

 阅读快车系列答案
阅读快车系列答案