题目内容
【题目】(1)下列几组物质中,互为同位素的是_______,互为同素异形体的是_______,互为同系物的是_______,互为同分异构体的是_______,属于同种物质的是_______。(用序号填空)
①O2 和O3 ②35Cl 和 37Cl ③CH3CH3 和 CH3CH2CH3④ 和
和 ⑤CH3(CH2)2CH3 和(CH3)2CHCH3
⑤CH3(CH2)2CH3 和(CH3)2CHCH3
(2)硫酸的性质有:A.高沸点;B.酸性;C.吸水性;D.脱水性;E.强氧化性。在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
①实验室干燥氢气_____;
②浓硫酸与金属铜的反应_____;
③浓硫酸使蔗糖变黑,且有刺激性气味的气体产生_____
(3)已知氯有 2 种常见同位素原子 35Cl、37Cl,氢有 3 种常见的同位素原子 H、D、T,氯气与氢气形成的氯化氢分子的相对分子质量可能有_____种。
(4)质量相同的 H2 16O 和 D2 16O 所含质子数之比为_____
(5)①CO2 ②CH3CH3 ③CaBr2 ④H2O2 ⑤NH4Cl ⑥AlCl3 ⑦NaOH ⑧NH3 ⑨Na2O2试用以上编号填空:既有极性键,又有非极性键的是_____;属于离子化合物的是_____;
【答案】② ① ③ ⑤ ④ C BE DE 5 10∶9 ②④ ③⑤⑦⑨
【解析】
(1)质子数相同,中子数不同的两种核素互为同位素,②互为同位素;同种元素组成的不同单质,互为同素异形体,①互为同素异形体;结构相似,组成上相差一个或多个CH2的互为同系物,③互为同系物;分子式相同,结构不同的两种化合物互为同分异构体,⑤互为同分异构体;④中两者均为二氯甲烷,故其为同一种物质,故答案为:②;①;③;⑤;④;
(2)①实验室干燥氢气利用的是浓硫酸的吸水性,故答案为:C;
②浓硫酸因为具有强氧化性而与金属铜能发生反应,反应生成了硫酸铜,也体现了硫酸的酸性,故答案为:BE;
③浓硫酸因为具有脱水性而能使蔗糖变黑碳化,而后又能将碳单质氧化成二氧化碳,自身被还原产生有刺激性气味的二氧化硫气体,故答案为:DE;
(3)氯与氢可形成相对分子质量分别为36、37、38、39、40的氯化氢,共5种,故答案为:5;
(4)H2 16O的相对分子质量为18,质子数为10,D2 16O的相对分子质量为20,质子数为10,则质量相同的两种物质所含质子数之比为![]() ,故答案为:10:9;
,故答案为:10:9;
(5)①CO2只含有极性共价键,属于共价化合物;②CH3CH3既有极性共价键又含有非极性共价键,属于共价化合物;③CaBr2含有离子键,属于离子化合物;④H2O2 既含有极性共价键又含有非极性共价键,属于共价化合物;⑤NH4Cl既含有极性共价键,又含有离子键,属于离子化合物;⑥AlCl3只含有极性共价键,属于共价化合物;⑦NaOH既含有极性共价键共价键又含有离子键,属于离子化合物;⑧NH3只含有极性共价键,属于共价化合物;⑨Na2O2既含有非极性共价键,又含有离子键,属于离子化合物,故答案为:②④;③⑤⑦⑨。

【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、Mg0少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属钰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:
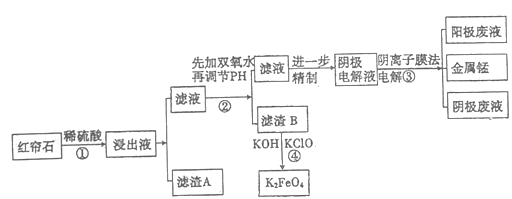
(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂:_______(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸 b.KOH c.氨水 d.MnCO3 e.CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_______________。
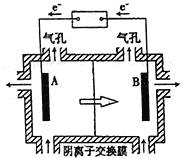
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;则与A电极连接的是直流电源的_____极。阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________。
【题目】现有部分元素的性质与原子(或分子)结构的相关信息如表所示:
元素编号 | 元素性质与原子(或分子)结构的相关信息 |
T | 最外层电子数是次外层电子数的 3 倍 |
X | 常温下单质分子为双原子分子,分子中含有 3 对共用电子对 |
Y | M 层比K 层少 1 个电子 |
Z | 其离子是第三周期金属元素的离子中半径最小的 |
(1)T、X、Y、Z 形成的简单离子半径由大到小的顺序是_____。(用离子符号表示)
(2)元素 Y 与元素 Z 相比,金属性较强的是_____(用元素符号表示),下列表述中能 证明这一事实的是_____(填字母序号)。
a.Y 单质的熔点比 Z 单质的低
b.Y 的化合价比Z 的低
c.常温下Y 单质与水反应的程度很剧烈,而Z 单质在加热条件下才能与水反应
d.Y 最高价氧化物对应的水化物的碱性比 Z 的强
(3)T、X、Y、Z 中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的电子式:________,元素 X 与氢元素以原子个数比 1∶2 化合形成常用于火箭燃料的化合物 W,写出 W 的电子式_______
(4)元素 T 和氢元素以原子个数比 1∶1 化合形成化合物 Q, Q 能与 W 发生氧化还原反应, 生成X 的单质和T 的另一种氢化物,写出该反应的化学方程式:_______

