题目内容
【题目】某研究性学习小组的甲、乙同学分别设计了以下实验来验证元素周期律。
(Ⅰ)甲同学在 a、b、c 三只烧杯里分别加入 50 mL 水,再分别滴加几滴酚酞溶液,依次加入 大小相近的锂、钠、钾块,观察现象。
①甲同学设计实验的目的是______
②反应最剧烈的烧杯是______(填字母);
③写出 b 烧杯里发生反应的离子方程式______
(Ⅱ)乙同学设计了下图装置来探究碳、硅元素的非金属性强弱,根据要求完成下列各小题
(1)实验装置:

(2)实验步骤: 连接仪器、______、加药品后,打开 a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是______,装置 E 中足量酸性 KMnO4 溶液 的作用是______。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是______;
③试管 D 中发生反应的离子方程式是______。
【答案】验证锂、钠、钾的金属性强弱; c 2Na+2H2O=2Na++2OH+ H2↑ 检查装置气密性 Cu+2H2SO4(浓)![]() CuSO4+ 2H2O+ SO2↑ 除去CO2中混有的SO2 盛有硅酸钠溶液的试管出现白色沉淀; SO2+ HCO3= CO2+ HSO3
CuSO4+ 2H2O+ SO2↑ 除去CO2中混有的SO2 盛有硅酸钠溶液的试管出现白色沉淀; SO2+ HCO3= CO2+ HSO3
【解析】
乙同学设计实验探究碳、硅元素的非金属性强弱。先用浓硫酸和铜在加热条件下制备二氧化硫气体,通入D试管与饱和碳酸氢钠反应生成二氧化碳,混合气体通入试管E,除去混有的二氧化硫,剩余的二氧化碳通入试管F与硅酸钠溶液反应,会出现白色沉淀。该实验需要改良的地方尾气处理装置,以及防干扰装置(防止空气中的二氧化碳进入装置F,干扰实验结构,可以加一个球星干燥管,内盛放碱石灰)。
(Ⅰ)①由某研究性学习小组设计实验验证元素周期律可得,甲同学设计的实验目的是:验证锂、钠、钾的金属性强弱;
②金属性:K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是c;’
③b 烧杯里发生反应的离子方程式:2Na+2H2O=2Na++2OH+ H2↑;
(Ⅱ)(2)实验步骤: 有气体参与反应,先连接仪器、检查装置气密性、加药品(先加固体,后加液体)后,打开 a、然后滴入浓硫酸,加热。
(3)①铜与浓硫酸反应的化学方程式是:Cu+2H2SO4(浓)![]() CuSO4+ 2H2O+ SO2↑;根据分析,高锰酸钾的作用是除去CO2中混有的SO2;
CuSO4+ 2H2O+ SO2↑;根据分析,高锰酸钾的作用是除去CO2中混有的SO2;
②非金属性越强,最高价氧化物的水化物酸性越强,若碳酸可以制得硅酸,则可以证明碳酸强于硅酸,从而可以证明二者非金属性的强弱,故能说明碳元素的非金属性比硅元素非金属性强的实验现象是:盛有硅酸钠溶液的试管出现白色沉淀;
③试管D用SO2与NaHCO3制备CO2,反应的离子方程式:SO2+ HCO3= CO2+ HSO3。

【题目】氯化镁纯品为无色单斜晶体,工业品通常呈黄褐色,有苦咸味。该物质可以形成六水合物,即六水氯化镁(MgCl2·6H2O),以下流程为由某混合物,制取纯净MgCl2·6H2O的生产过程:

已知:在本流程中,
Fe3+ | Fe2+ | Al3+ | Mg2+ | |
开始沉淀pH | 1.5 | 6.5 | 3.3 | 8.4 |
完全沉淀pH | 4.1 | 9.7 | 5.5 | 10.9 |
试回答下列问题:
(1)操作1所需玻璃仪器为____________________。
(2)流程中加入试剂2调节pH的范围是________;加入试剂2能形成沉淀的原因是___________________。
(3)操作3为加入足量的盐酸,然后经过___________、____________,过滤,洗涤,干燥;在操作不当的情况下,若MgCl2·6H2O受热则会发生水解形成碱式盐,则该反应的化学方程式为____________________。
(4)若25℃下,Ksp[Mg(OH)2]=4×10-12,则该温度下,将Mg(OH)2溶于水形成饱和溶液,则其饱 和溶液的pH=_________。(已知:lg5=0.7)
【题目】图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
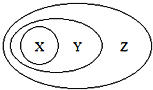
X | Y | Z | |
A | NaAlO2 | 盐 | 纯净物 |
B | 胶体 | 分散系 | 混合物 |
C | Al2O3 | 两性氧化物 | 氧化物 |
D | 单质参与反应 | 置换反应 | 氧化还原反应 |
A. A B. B C. C D. D





