题目内容
【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、Mg0少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属钰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:

(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂:_______(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸 b.KOH c.氨水 d.MnCO3 e.CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_______________。
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;则与A电极连接的是直流电源的_____极。阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________。

【答案】 MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O Mn2+、Mg2+、Al3+ d b 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 负 2.24L
【解析】(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,该反应的离子方程式: MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O。
(2) 红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、Mg0少量MnO2等,加稀硫酸后发生反应,浸出液中的阳离子除H+、Fe2+、Fe3+外还有Mn2+、Mg2+、Al3+ 。
(3)步骤②中调节溶液的pH等于6,最好选用MnCO3,不会增加新杂质。根据表中所给数据,pH=6时,Fe3+、Al3+完全沉淀,所以滤渣B的成分为Fe(OH)3和Al(OH)3,除去Al(OH)3可加入 KOH溶液,使Al(OH)3溶解。本题答案:d b。
(4) 滤渣B含Fe(OH)3,被ClO氧化为FeO42,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(5)电解时,电解质溶液中阴离子移向阳极,所以电极B与直流电源的正极相连做阳极,则A电极与直流电源的负极相连做阴极;若阴极上只有锰单质析出,当生成11g锰为0.2mol时,Mn2+![]() Mn
Mn![]() 2e— 转移的电子数为0.4mol,阳极:4OH--4e—=O2↑+2H2O,产生的氧气为0.1mol,标况下体积为2.24L。答案:负 . 2.24L。
2e— 转移的电子数为0.4mol,阳极:4OH--4e—=O2↑+2H2O,产生的氧气为0.1mol,标况下体积为2.24L。答案:负 . 2.24L。

 名校课堂系列答案
名校课堂系列答案【题目】硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
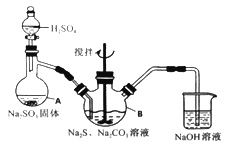
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
……
(1)写出仪器A的名称_______。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH <7,请用离子方程式解释原因_________。
(3)写出三颈烧瓶B中制取Na2S2O3,反应的总化学反应方程式________。
(4)从上述生成物混合液中获得较高产率Na2S2O3·5H2O的步骤为
为减少产品的损失,操作①为趁热过滤,“趁热”的原因是______;操作②是______;操作①是抽滤、洗涤、干燥。
(5)测定产品纯度
取6.00g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.500mol/LI2的标准溶液进行滴定,反应原理为2S2O32-+I2=S4O62-+2I-。相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
滴定时,达到滴定终点的现象是___________。产品的纯度为____________。
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________。
【题目】(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元紧对应原子的M层电子排布式为________________。
(2)如下图2所示,每条折线表示周期表IVA-VIIA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是____________。
(3)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为__________(填序号)。
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因__________。
(4)CO2在高温高压下所形成的晶体其晶胞如下图3所示。该晶体的熔点比SiO2晶体______(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为____________。

(5)如图为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;

则:C20分子共有____个正五边形,共有______条棱边。
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断Ni2+的水合离子为______(填“有”或“无”)色离子,依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(7)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为p=5.71g/cm3,晶胞边长为4.28×10-10m,FexO中x值(精确至0.01)为_______。