题目内容
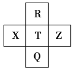
【题目】现有部分元素的性质与原子(或分子)结构的相关信息如表所示:
元素编号 | 元素性质与原子(或分子)结构的相关信息 |
T | 最外层电子数是次外层电子数的 3 倍 |
X | 常温下单质分子为双原子分子,分子中含有 3 对共用电子对 |
Y | M 层比K 层少 1 个电子 |
Z | 其离子是第三周期金属元素的离子中半径最小的 |
(1)T、X、Y、Z 形成的简单离子半径由大到小的顺序是_____。(用离子符号表示)
(2)元素 Y 与元素 Z 相比,金属性较强的是_____(用元素符号表示),下列表述中能 证明这一事实的是_____(填字母序号)。
a.Y 单质的熔点比 Z 单质的低
b.Y 的化合价比Z 的低
c.常温下Y 单质与水反应的程度很剧烈,而Z 单质在加热条件下才能与水反应
d.Y 最高价氧化物对应的水化物的碱性比 Z 的强
(3)T、X、Y、Z 中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的电子式:________,元素 X 与氢元素以原子个数比 1∶2 化合形成常用于火箭燃料的化合物 W,写出 W 的电子式_______
(4)元素 T 和氢元素以原子个数比 1∶1 化合形成化合物 Q, Q 能与 W 发生氧化还原反应, 生成X 的单质和T 的另一种氢化物,写出该反应的化学方程式:_______
【答案】N3->O2->Na+>Al3+ Na cd ![]()
![]() 2H2O2+N2H4=N2+4H2O
2H2O2+N2H4=N2+4H2O
【解析】
T最外层电子数是次外层电子数的 3 倍,T为氧元素;X常温下单质分子为双原子分子,分子中含有 3 对共用电子对,X为氮元素;Y 的原子结构中M 层比K 层少 1 个电子,Y为钠元素;Z的离子是第三周期金属元素的离子中半径最小的,Z为铝元素。
(1)根据元素周期律,电子层数相同时,序数小的离子半径大,则T、X、Y、Z 形成的简单离子半径由大到小的顺序是N3->O2->Na+>Al3+,故答案为:N3->O2->Na+>Al3+;
(2)根据元素周期律,同周期元素,金属性从左到右逐渐减弱,则钠的金属性比铝的金属性强;
a.熔点为物理性质,不能用熔点大小来比较金属性强弱,故a错误;
b.化合价可以衡量得失电子的数目,但不能用来说明是否容易得失电子,则不能通过钠和铝的化合价来说明钠和铝的金属性强弱,故b错误;
c.通过比较钠和铝与水反应的剧烈程度,可知钠比铝活泼,即钠的金属性强于铝,故c正确;
d.根据元素周期律,金属性强的元素对应的碱的碱性也强,故d正确;
综上所述,故答案为:Na;cd;
(3)由两种元素形成的既含有离子键又含有共价键的化合物为过氧化钠,其电子式为![]() ;氮元素与氢元素形成的化合物W为N2H4,可用于作火箭的燃料,其电子式为
;氮元素与氢元素形成的化合物W为N2H4,可用于作火箭的燃料,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(4)化合形成化合物 Q为双氧水,化合物W为N2H4,二者发生氧化还原反应生成氮气和水,其反应的化学方程式为2H2O2+N2H4=N2+4H2O,故答案为:2H2O2+N2H4=N2+4H2O。

【题目】一定条件下,可逆反应2A(g)![]() B(g)+3C(g),反应处于平衡状态的是( )
B(g)+3C(g),反应处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | v(A)=2mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
B | v(A)=2mol·L-1·min-1 | v(C)=2mol·L-1·min-1 |
C | v(A)=1mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
D | v(A)=1mol·L-1·min-1 | v(C)=1.5mol·L-1·min-1 |
A.AB.BC.CD.D
【题目】(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为________。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为:![]() ,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题:
①前2s内的平均反应速率υ(N2)=____;
②上述条件下,该反应的平衡常数为____;
③上述条件下,测得某时刻反应体系中各物质的物质的量浓度均为0.01mol/L,则此时反应处于___状态。(填“平衡”或“向右进行”或“向左进行”)
(3)实验室常用0.10mol/L KMnO4标准酸性溶液来测定H2C2O4样品的纯度(标准液滴待测液),其反应原理为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O。
①KMnO4标准液应装在____(填“酸式”或“碱式”)滴定管;
②清水洗净滴定管后直接装入标准液,则测定结果会____;(填“偏大”或“偏小”或“不变”)