题目内容
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
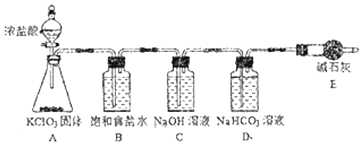
(1)该小组按如图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如表。(已知饱和NaClO溶液pH为11)
实验步骤 | 实验现象 | ||
B瓶 | C瓶 | D瓶 | |
实验1:取样,滴加紫色石蕊溶液 | 变红,缓慢褪色 | 变红,缓慢褪色 | 立即褪色 |
实验2:取样,测定溶液的pH | 3 | 12 | 7 |
①装置A中反应的化学方程式为____。
②B瓶溶液中H+的主要来源是____。
③C瓶溶液的溶质是___(填化学式)。
④结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因____。
(2)测定C瓶溶液中NaClO含量(单位:gL-1)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000molL-1Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00mLNa2S2O3溶液。(I2+2S2O32-=2I-+S4O62-)
①NaClO的电子式为____。
②步骤Ⅰ总反应的离子方程式为____。
③C瓶溶液中NaClO的含量为____gL-1。(保留1位小数,NaClO式量为74.5)
【答案】KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O 氯气中混有氯化氢 NaClO、NaCl、NaOH 溶液中存在平衡Cl2+H2OHCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大 ![]() ClO-+2I-+2H+=I2+Cl-+H2O 3.7
ClO-+2I-+2H+=I2+Cl-+H2O 3.7
【解析】
在A装置中用KClO3和浓盐酸制取氯气,由于盐酸挥发,氯气中会混有HCl,通过饱和食盐水除去氯气中的HCl,然后通入NaOH溶液中,氯气和NaOH反应生成NaCl、NaClO;然后氯气进入D中,D中是NaHCO3和石蕊的混合液,氯气和水生成盐酸和次氯酸:Cl2+H2OHCl+HClO是可逆反应,由于NaHCO3的存在,会消耗HCl,使平衡右移,生成更多的HClO,从而使石蕊试液很快褪色。最后用碱石灰吸收过量的氯气,防止污染环境。
(1)①装置A中氯酸钾固体和浓盐酸反应生成氯气,反应的化学方程式为KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O,故答案为:KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O;
②B瓶溶液滴加紫色石蕊溶液变红色,说明含氢离子,B瓶溶液中H+的主要来源是氯气中所含氯化氢,故答案为:氯气中混有氯化氢;
③氯气和装置C中氢氧化钠溶液反应生成氯化钠、次氯酸钠,C瓶溶液的溶质是NaClO、NaCl、NaOH,故答案为:NaClO、NaCl、NaOH;
④D瓶溶液中石蕊立即褪色的原因是:溶液中存在平衡Cl2+H2OHCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大,故答案为:溶液中存在平衡Cl2+H2OHCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大;
(2)①NaClO是有钠离子和次氯酸根离子构成,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
②步骤Ⅰ总反应是次氯酸钠在酸溶液中氧化碘化钾生成碘单质,反应的离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O,故答案为:ClO-+2I-+2H+=I2+Cl-+H2O;
③ClO-+2I-+2H+=I2+Cl-+H2O,I2+2S2O32-=2I-+S4O62-,

n=0.001mol,C瓶溶液中NaClO的含量=![]() =3.7g/L,故答案为:3.7。
=3.7g/L,故答案为:3.7。

 阅读快车系列答案
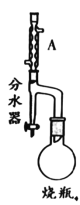
阅读快车系列答案【题目】实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
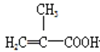 +CH3OH
+CH3OH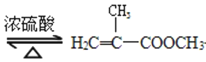 +H2O
+H2O
药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(gcm-3) |
甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
已知甲基丙烯酸甲酯受热易聚合;甲基丙烯酸甲酯在盐溶液中溶解度较小;CaCl2可与醇结合形成复合物;
实验步骤:
①向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;
②在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热 烧瓶。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中;
③当 ,停止加热;
④冷却后用试剂 X 洗涤烧瓶中的混合溶液并分离;
⑤取有机层混合液蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是_____。
(2)请将步骤③填完整____。
(3)上述实验可能生成的副产物结构简式为_____(填两种)。
(4)下列说法正确的是______
A.在该实验中,浓硫酸是催化剂和脱水剂
B.酯化反应中若生成的酯的密度比水大,不能用分水器提高反应物的转化率
C.洗涤剂X是一组试剂,产物要依次用饱和Na2CO3、饱和CaCl2溶液洗涤
D.为了提高蒸馏速度,最后一步蒸馏可采用减压蒸馏;该步骤一定不能用常压蒸馏
5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_____。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是_____。
A.分水器收集的水里含甲基丙烯酸甲酯
B.实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失