题目内容
14.按要求回答下列问题.写出除去下列物质所含杂质(括号内为杂质)所用的试剂或方法:
①Na2CO3固体(NaHCO3)加热
②FeCl3溶液(FeCl2)Cl2
③Mg粉(Al)NaOH溶液(或KOH溶液)
④CO2(SO2)KMnO4(H+)溶液(或饱和NaHCO3溶液)
⑤Cu(CuO)稀硫酸.
分析 ①碳酸氢钠加热分解生成碳酸钠;
②氯气氧化氯化亚铁生成氯化铁;
③Al能与强碱反应,而Mg不能与碱反应,再过滤分离;
④二氧化硫有还原性,能与酸性高锰酸钾反应生成硫酸;二氧化硫能与饱和的碳酸氢钠反应反应生成二氧化碳;
⑤Cu与稀硫酸不反应,可加入稀硫酸除去CuO.
解答 解:①由于碳酸氢钠加热分解生成碳酸钠,故可以加热方法除去混有的碳酸氢钠,故答案为:加热;
②氯气氧化氯化亚铁生成氯化铁,用氯气除去氯化铁溶液中混有的氯化亚铁,故答案为:Cl2;
③Al与NaOH溶液(或KOH溶液)反应反应,而Mg不能反应,再进行过滤分离,可以除去混有的Al,故答案为:NaOH溶液(或KOH溶液);
④二氧化硫有还原性,能与酸性高锰酸钾反应生成硫酸;二氧化硫能与饱和的碳酸氢钠反应反应生成二氧化碳,可以用KMnO4(H+)溶液(或饱和NaHCO3溶液)除去二氧化碳中混有的二氧化硫,故答案为:KMnO4(H+)溶液(或饱和NaHCO3溶液);
⑤Cu与稀硫酸不反应,可加入稀硫酸除去CuO,故答案为:稀硫酸.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力、实验能力和评价能力的考查,难度不大,注意把握物质的性质的异同,注意除杂时不能引入新的杂质.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
5.将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示.生产过程中应将温度控制在600℃左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是CuSO4发生了分解反应.
(2)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).实验中可选用的试剂和用品:稀硫酸、3% H2O2溶液、CuO、玻璃棒、精密pH试纸.
①实验时需用约3%的H2O2溶液100mL,现用市售30%(密度近似为1g•cm-3)的H2O2来配制,其具体配制方法是用量筒量取10mL30%H2O2溶液加入烧杯中,再加入90mL 水(或加水稀释至 100mL),搅拌均匀.
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤.
第二步:向滤液中加入稍过量3% H2O2溶液,充分反应.
第三步:向溶液中加入CuO,用精密pH试纸控制pH在3.2~4.7之间,过滤.
第四步:加热浓缩、冷却结晶.
第五步:过滤、洗涤,低温干燥.
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O.

(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示.生产过程中应将温度控制在600℃左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是CuSO4发生了分解反应.
(2)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).实验中可选用的试剂和用品:稀硫酸、3% H2O2溶液、CuO、玻璃棒、精密pH试纸.
①实验时需用约3%的H2O2溶液100mL,现用市售30%(密度近似为1g•cm-3)的H2O2来配制,其具体配制方法是用量筒量取10mL30%H2O2溶液加入烧杯中,再加入90mL 水(或加水稀释至 100mL),搅拌均匀.
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤.
| 粒子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
第三步:向溶液中加入CuO,用精密pH试纸控制pH在3.2~4.7之间,过滤.
第四步:加热浓缩、冷却结晶.
第五步:过滤、洗涤,低温干燥.
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O.
2.下列化学式只表示一种纯净物的是( )
| A. | C3H8 | B. | C4H10 | C. | C2H4Br2 | D. | C3H8O |
19.常温常压下,某气态烃和氧气的混合气体20L,完全燃烧后通过浓硫酸后,再恢复到原来条件,气体体积变为原来的一半.设烃完全燃烧无剩余,则该烃可能是( )
①CH4 ②C2H4 ③C2H2 ④C2H6 ⑤C3H6 ⑥C3H4 ⑦C3H8 ⑧C4H6.
①CH4 ②C2H4 ③C2H2 ④C2H6 ⑤C3H6 ⑥C3H4 ⑦C3H8 ⑧C4H6.
| A. | 只有①③④ | B. | ⑤⑥⑦⑧ | C. | 只有②⑦ | D. | ①②④⑦ |
3.下列关于元素周期律的叙述正确的是( )
| A. | 随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 | |
| D. | 主族元素原子的最高正价和负价的绝对值之和一定是8 |

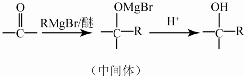
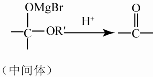
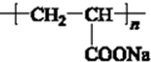

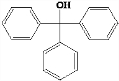 .
.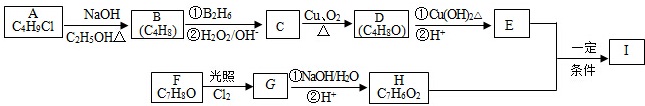
 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$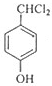 +2HCl,该反应类型为取代反应.
+2HCl,该反应类型为取代反应. .
. .
.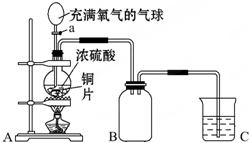 小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.
小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.