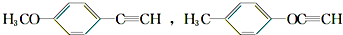题目内容
13.苄叉二氯(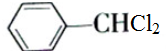 ,沸点206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图所示.
,沸点206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图所示.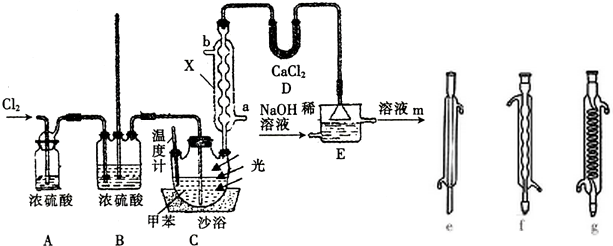
回答下列问题:
(1)实验室常用高锰酸钾与浓盐酸制取氯气,反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
(2)图中装置A的作用是干燥氯气;装置B的作用是起安全瓶的作用,能起缓冲作用;装置D的作用是吸收水蒸气
(3)仪器X的名称为冷凝管,冷凝水从a(填“a”或“b”)口进入;装置C中甲苯与Cl2反应生成苄叉二氯的化学方程式为
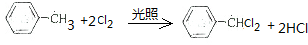 .
.(4)最后蒸馏收集204~208℃的馏分,蒸馏时用的冷凝管可选用如图中的e(填字母).
(5)若实验前甲苯的质量为46g,最后苄叉二氯的质量也是46g,则该实验的产率为57.1%.
(6)设计实验证明溶液m中含有ClO-:在试样中滴入2-3滴紫色石蕊溶液,若看到石蕊溶液先由紫变蓝,然后褪成无色,即使加热也无法恢复,则说明含有ClO-.
分析 (1)用高锰酸钾跟浓盐酸反应在室温下制氯气,在酸性条件下,MnO4-被还原成Mn2+,依据氧化还原反应电子守恒、电荷守恒、原子守恒配平写出;
(2)浓硫酸具有吸水,能干燥氯气,装置B中有长玻璃管,可以起安全瓶的作用,能起缓冲作用,使氯气匀速进入三口烧瓶中,氯化钙是干燥剂,能吸收从C装置中出来的水蒸气;
(3)根据装置图可知仪器X为冷凝管,根据采用逆流冷却的效果好判断进水口;甲苯与氯气在光照条件下发生取代反应可以生成二氯甲苯和氯化氢;
(4)由于球形冷凝管和蛇形冷凝管容易使深阻塞在曲管内,所以用直形冷凝管比较好;
(5)甲苯的质量为46g,根据转化关系,每摩尔甲苯氧化后可得1mol苄叉二氯,所以理论上可得苄叉二氯的质量为$\frac{46}{92}$×161g=80.5g,根据产率=$\frac{实际产量}{理论产量}$×100%计算;
(6)根据次氯酸有漂白性且不能恢复可证明溶液m中含有ClO-.
解答 解:(1)用高锰酸钾跟浓盐酸反应在室温下制氯气,在酸性条件下,MnO4-被还原成Mn2+,依据氧化还原反应电子守恒、电荷守恒、原子守恒配平写出离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)浓硫酸具有吸水,能干燥氯气,装置B中有长玻璃管,可以起安全瓶的作用,能起缓冲作用,使氯气匀速进入三口烧瓶中,氯化钙是干燥剂,能吸收从C装置中出来的水蒸气,
故答案为:干燥氯气;起安全瓶的作用,能起缓冲作用;吸收水蒸气;
(3)根据装置图可知仪器X为冷凝管,根据采用逆流冷却的效果好判断进水口,所以进水口为a,甲苯与氯气在光照条件下发生取代反应可以生成二氯甲苯和氯化氢,反应方程式为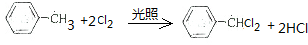 ,
,
故答案为:冷凝管;a;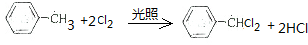 ;
;
(4)由于球形冷凝管和蛇形冷凝管容易使深阻塞在曲管内,所以用直形冷凝管比较好,故选e;
(5)甲苯的质量为46g,根据转化关系,每摩尔甲苯氧化后可得1mol苄叉二氯,所以理论上可得苄叉二氯的质量为$\frac{46}{92}$×161g=80.5g,所以产率=$\frac{46g}{80.5g}$×100%=57.1%,
故答案为:57.1%;
(6)根据次氯酸有漂白性且不能恢复可证明溶液m中含有ClO-,操作为在试样中滴入2-3滴紫色石蕊溶液,若看到石蕊溶液先由紫变蓝,然后褪成无色,即使加热也无法恢复,则说明含有ClO-,
故答案为:在试样中滴入2-3滴紫色石蕊溶液,若看到石蕊溶液先由紫变蓝,然后褪成无色,即使加热也无法恢复,则说明含有ClO-.
点评 本题考查有机物合成实验、物质的分离等基本操作、对实验装置的分析评价等,较好的考查学生对数据的应用、阅读获取信息的能力以及知识迁移应用,难度中等.

| A. | 20mL,2.5mol/L | B. | 30mL,2mol/L | C. | 10ml,5mol/L | D. | 20mL,2mol/L |
| A. | 反应中 KClO做还原剂 | |
| B. | KCl是还原产物 | |
| C. | K2FeO4中铁的化合价为+7 | |
| D. | 制备K2FeO4时,1 molFe(OH)3得到3 mol电子 |
| A. | 向Na2SO3、NaI的混合溶液中滴加少量氯水:2I-+C12═2Cl-+I2 | |
| B. | 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaSiO3+H2O | |
| C. | 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| D. | 漂白粉和“洁厕灵”(主要成分浓盐酸)混合使用放出氯气:ClO-+Cl-+2H+═Cl2↑+H2O |
| A. | N×10-2mol•L-1 | B. | $\frac{N}{1.024×1{0}^{22}}$mol•L-1 | ||
| C. | $\frac{N}{6.02×1{0}^{21}}$mol•L-1 | D. | $\frac{N}{6.02×1{0}^{25}}$mol•L-1 |
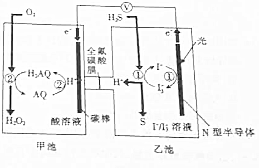 我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2─H2O2+S↓.
我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2─H2O2+S↓.已知甲池中发生的反应为:
 下列说法正确的是( )
下列说法正确的是( )| A. | 该装置将电能转化为光能 | |
| B. | H+从甲池移向乙池 | |
| C. | 甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ | |
| D. | 乙池溶液中发生的反应为H2S+I3-═3I-+S↓+2H+ |
| A. | 1 L水溶解了0.5 molNaCl,则该溶液的物质的量浓度为0.5 mol•L-1 | |
| B. | 把100g 18.4 mol•L-1的硫酸与等质量的水混合,所得溶液的浓度小于9.2 mol•L-1 | |
| C. | 将 100g10%的盐酸加热蒸发,得到 50 g溶液,其质量分数为20% | |
| D. | 把200mL3 mol•L-1的BaCl2溶液跟100mL3 mol•L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol•L-1 |
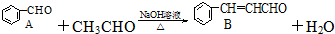
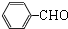 +2Cu(OH)2$\stackrel{△}{→}$c
+2Cu(OH)2$\stackrel{△}{→}$c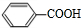 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.