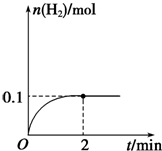
题目内容
3.下列说法正确的是( )| A. | 1 L水溶解了0.5 molNaCl,则该溶液的物质的量浓度为0.5 mol•L-1 | |
| B. | 把100g 18.4 mol•L-1的硫酸与等质量的水混合,所得溶液的浓度小于9.2 mol•L-1 | |
| C. | 将 100g10%的盐酸加热蒸发,得到 50 g溶液,其质量分数为20% | |
| D. | 把200mL3 mol•L-1的BaCl2溶液跟100mL3 mol•L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol•L-1 |
分析 A.0.5 molNaCl溶于水配成1L溶液,所得溶液的物质的量浓度为0.5 mol•L-1;
B.混合后所得硫酸溶液密度小于18.4 mol•L-1的硫酸的密度,则混合后溶液体积大于18.4 mol•L-1的硫酸体积的2倍,结合稀释定律判断;
C.加热HCl挥发;
D.3mol•L-1的BaCl2溶液中氯离子浓度为6mol•L-1,3mol•L-1的KCl溶液中氯离子浓度为L3mol•L-1,混合后氯离子浓度介于之间3mol•L-1~6mol•L-1.
解答 解:A.0.5 molNaCl溶于水配成1L溶液,所得溶液的物质的量浓度为0.5 mol•L-1,不是溶剂水的体积为1L,故A错误
B.混合后所得硫酸溶液密度小于18.4 mol•L-1的硫酸的密度,则混合后溶液体积大于18.4 mol•L-1的硫酸体积的2倍,稀释中溶质硫酸的物质的量不变,则混合所得溶液的浓度小于9.2 mol•L-1,故B正确;
C.加热HCl挥发,溶液中HCl质量分数减小,故C错误
D.3mol•L-1的BaCl2溶液中氯离子浓度为6mol•L-1,3mol•L-1的KCl溶液中氯离子浓度为L3mol•L-1,混合后氯离子浓度介于之间3mol•L-1~6mol•L-1,故D错误,
故选:B.
点评 本题考查物质的量浓度概念及有关计算,注意对定义式的理解与灵活应用,C信息为易错点,学生容易忽略HCl挥发.

练习册系列答案
相关题目
11.设NA为阿伏加德罗常数,下列说法不正确的是( )
| A. | 标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA | |
| B. | 23g金属钠变为钠离子时失去的电子数为NA | |
| C. | 2.0g重水(D2O)中含有的中子数为NA | |
| D. | 常温常压下,48gO3和O2混合气体中含有的氧原子数为3NA |
15.“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是( )
| A. | 活化分子之间的碰撞一定是有效碰撞 | |
| B. | 增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快 | |
| C. | 对于有气体参加的反应增大压强,可使单位体积内活化分子增多,反应速率加快 | |
| D. | 催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
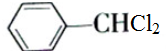 ,沸点206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图所示.
,沸点206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图所示.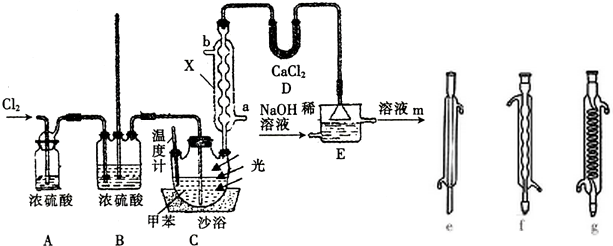
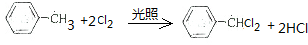 .
.