题目内容
1.高铁酸钾(K2FeO4)是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3+3KClO+4KOH═2K2FeO4+3KCl+5H2O,下列说法正确的是( )| A. | 反应中 KClO做还原剂 | |
| B. | KCl是还原产物 | |
| C. | K2FeO4中铁的化合价为+7 | |
| D. | 制备K2FeO4时,1 molFe(OH)3得到3 mol电子 |
分析 2Fe(OH)3+3KClO+4KOH→2K2FeO4+3KCl+5H2O中,Fe元素的化合价由+3价升高为+6价,Cl元素的化合价由+1价降低为-2价,以此来解答.
解答 解:A.Cl元素的化合价降低,则KClO是氧化剂,故A错误;
B.Cl元素的化合价降低,则KClO是氧化剂,则KCl是还原产物,故B正确;
C.高铁酸钾中铁的化合价为+6价,故C错误;
D.制备K2FeO4时,1molFe(OH)3失去电子为1mol×(6-3)=3 mol,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子数的考查,题目难度不大.

练习册系列答案
相关题目
11.下列叙述正确的是( )
| A. | 除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属族的族序数 | |
| B. | 在周期表里,主族元素所在的族序数等于原子核外电子数 | |
| C. | 副族元素没有非金属元素 | |
| D. | 元素的原子序数越大,其原子半径也越大 |
9.短周期元素X、Y、Z在元素周期表中的位置如图所示,其中Y元素原子的最外层电子数是电子层数的两倍.回答下列问题:
(1)Z元素在元素周期表中的位置是第三周期第VIA族.
(2)下列能证明Y元素与Z元素的得电子能力强弱的是BC.(填序号)
A.氢化物水溶液的酸性 B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性 D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示)S2->Cl-
(4)X元素的某种气态氢化物分子中含有10个电子.该物质在加热条件下能够将CuO还原为Cu,同时生成一种气体,该气体是空气中的成分之一.则反应的化学方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2.若反应中有6.02×1022个电子发生转移,则有4g的CuO参加反应.
| X | ||
| Y | Z |
(2)下列能证明Y元素与Z元素的得电子能力强弱的是BC.(填序号)
A.氢化物水溶液的酸性 B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性 D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示)S2->Cl-
(4)X元素的某种气态氢化物分子中含有10个电子.该物质在加热条件下能够将CuO还原为Cu,同时生成一种气体,该气体是空气中的成分之一.则反应的化学方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2.若反应中有6.02×1022个电子发生转移,则有4g的CuO参加反应.
10.常温下,PH都等于5的盐酸、醋酸、氯化铵溶液中,水的电离度分别为a1、a2、a3,则他们的关系是( )
| A. | a1=a2>a3 | B. | a1>a2>a3 | C. | a1=a2<a3 | D. | a1<a2<a3 |
11.设NA为阿伏加德罗常数,下列说法不正确的是( )
| A. | 标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA | |
| B. | 23g金属钠变为钠离子时失去的电子数为NA | |
| C. | 2.0g重水(D2O)中含有的中子数为NA | |
| D. | 常温常压下,48gO3和O2混合气体中含有的氧原子数为3NA |
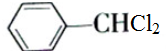 ,沸点206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图所示.
,沸点206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图所示.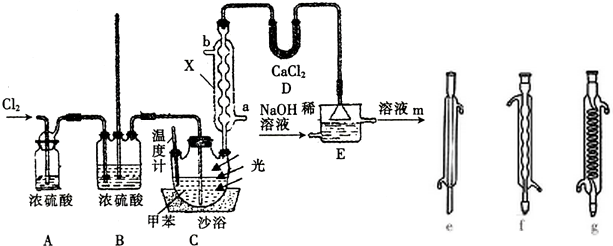
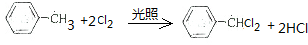 .
.